5.1: Historia
- Page ID
- 70280
Coordinación Química
Ahora dirijamos nuestro enfoque hacia la química de coordinación real, también llamada a menudo química compleja. A continuación, aplicaremos los conceptos previamente aprendidos sobre teoría atómica, simetría, teoría orbital molecular y química ácido-base a los compuestos de coordinación. Preguntemos primero: ¿Cómo se definen los compuestos o complejos de coordinación? Normalmente son aductos de base de ácido de Lewis entre un átomo de metal o un ion metálico como el ácido de Lewis y uno o más ligandos como una base de Lewis. Estos ligandos pueden ser ligandos inorgánicos tales como iones de halógenos, agua y moléculas de amoníaco, o ligandos orgánicos como aminas o alcoholes. Los compuestos de coordinación son conocidos desde la antigüedad debido a su color a menudo intenso, y se utilizan como pigmento o tinte, por ejemplo Azul Prusia (KFe [Fe (CN) 6] o cobre tetrammina, ambos de color azul intenso. A continuación se pueden ver algunos ejemplos de compuestos de coordinación, a saber, el hexahidrato de sulfato de cobre (II) que es azul, el cloruro de hierro (III), que es amarillo, y el sulfato de níquel que es de color azul verdoso. Por su intenso color también han atraído la atención de los químicos modernos desde el principio, pero la unión química en estos compuestos siguió siendo un misterio por un tiempo relativamente largo. La unión en estos compuestos parecía más compleja, de ahí el nombre de compuestos complejos.

Historia de los Compuestos de Coordinación
¿Cuál era el problema con la vinculación en los compuestos de coordinación? Sus fórmulas empíricas podrían determinarse fácilmente mediante el análisis de elementos, pero los resultados no pudieron explicarse con el concepto de valencia. En los primeros días de la química moderna se creía que el número de enlaces en un compuesto no podía superar la valencia. Por ejemplo, en el compuesto de la fórmula Co (NH 3) 6 Cl 3 la valencia de Co sería +3, por lo que el cobalto no podría hacer más de tres enlaces. Suponiendo que el ion Co 3+ haría tres enlaces a los 3 iones Cl -, ¿cómo involucraría uno a las seis moléculas NH 3 en el enlace?

El químico que resolvió este misterio fue Alfred Werner. Sugirió correctamente que el número de bonos no se restringiría a la valencia, sino que se permitirían más bonos. Sería posible que las seis moléculas NH 3 se unan directamente al Co 3 + formando un llamado catión complejo. Estarían en la llamada primera esfera de coordinación alrededor de la Co. Los tres iones cloruro se unirían entonces de forma suelta al catión complejo equilibrando la carga del catión complejo. Estarían en el segundo ámbito de coordinación.
Redacción de fórmulas en Química de Coordinación
¿Cómo podemos escribir una fórmula de un compuesto de coordinación que contenga iones complejos?
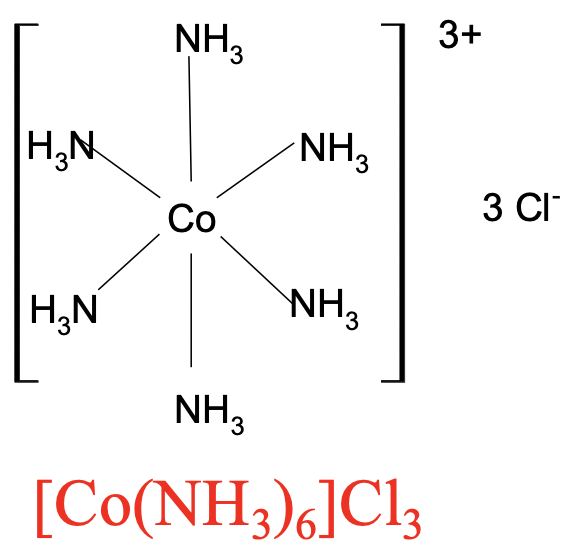
Para cationes complejos escribimos primero el símbolo del elemento para el ión metálico seguido de la fórmula para los ligandos. Si hay más de un ligando, entonces colocaremos los ligandos entre paréntesis, e indicaremos su número por un subíndice detrás de los paréntesis. Todo el catión complejo se coloca entre paréntesis. La fórmula para el anión en la segunda esfera de coordinación se coloca detrás de los corchetes y el número de aniones se indica con un subíndice (Fig. 5.1.3).
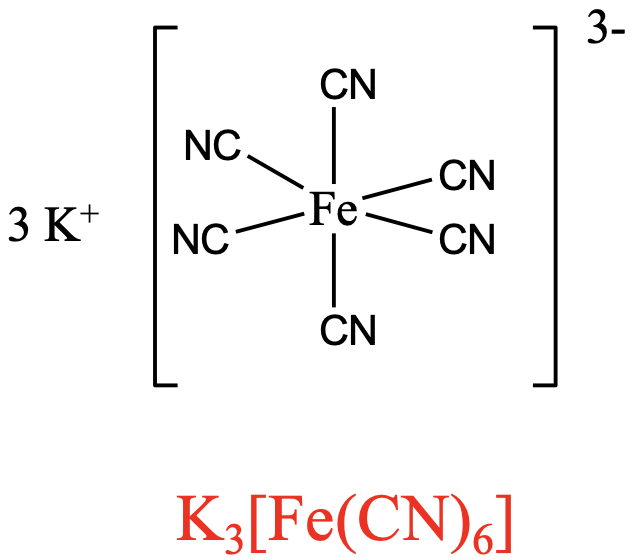
Para aniones complejos, escribimos primero la fórmula para el contracatión, seguido del anión complejo entre paréntesis. Se pueden ver dos ejemplos anteriores (Fig. 5.1.3 y 5.1.4). Contamos con cationes complejos de Co con seis ligandos NH 3 coordinados a él en la primera esfera de coordinación. Tres iones Cl - están en la segunda esfera de coordinación. De ahí que la fórmula sea [Co (NH 3) 6] Cl 3. El segundo ejemplo es el compuesto de coordinación con el anión complejo que tiene una carga 3 en la que seis aniones cianuro se unen a un ion Fe 3 + central. El ion K + en la segunda esfera de coordinación compensa la carga del anión complejo. De ahí que la fórmula sea K 3 [Fe (CN) 6].


