5.2: Nomenclatura
- Page ID
- 70269
Clasificación de Ligandos
Veamos un poco más de cerca los ligandos y veamos cómo podemos clasificarlos. Una forma es categorizarlos en ligandos monodentados y multidentados.
Los ligandos monodentados tienen solo un punto de unión al ión metálico.
Definición: Ligando monodentado
Los ligandos monodentados tienen solo un punto de unión al ión metálico
Ejemplos de tales ligandos son ligandos de halógenos, amoníaco como ligando y agua como ligando. Las moléculas suelen tener diferentes nombres cuando actúan como ligandos, y debes conocer estos nombres. Por ejemplo, el agua como ligando se llama ligando de agua, el amoníaco como ligando se llama ligando de amina, el cloruro como ligando se llama ligando de cloro.
Los ligandos con más de un punto de unión se denominan ligandos multidentados o ligandos quelatos.
Definición: Ligandos multidentados
Los ligandos multidentados tienen dos o más puntos de unión al ión metálico.
Los complejos con ligandos de quelato se denominan complejos de quelato. Los prefijos griegos indican cuántos puntos de unión tiene el ligando (Fig. 5.2.1).

Si hay dos, entonces tenemos un ligando bidentado, cuando hay tres, tenemos un ligando tridentado. Utilizamos los prefijos tetra, penta y hexa para indicar cuatro, cinco y seis puntos de unión, respectivamente. Los ligandos multidentados con más de seis puntos de unión son raros.

El nombre ligando quelato proviene de la palabra griega chela, que significa gran garra de la langosta. Podemos ver que nuestra langosta en la Figura 5.2.2 felizmente quelata un ion Ni 2 + con sus dos grandes garras!
Ligandos bidentados comunes
A continuación se muestran algunos ligandos bidentados comunes.
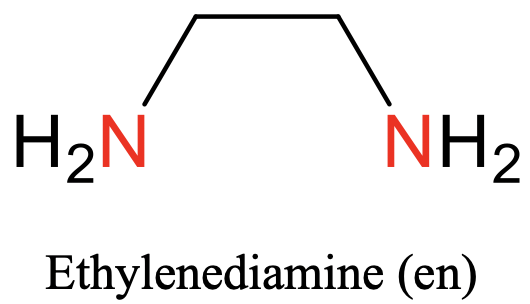
El primero es la etilendiamina. Tiene dos átomos donadores de nitrógeno que pueden unirse al metal, y están separados por un grupo etileno (Fig. 5.2.3).
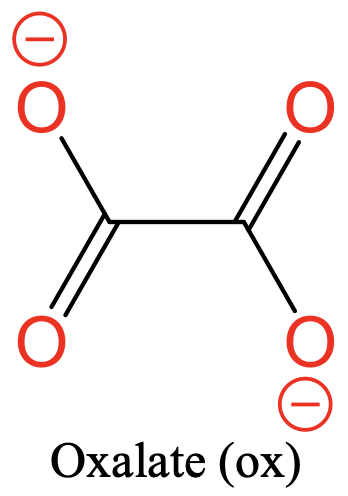
Otro ligando común es el ligando oxalato. Tiene dos átomos donadores de O separados por dos átomos de carbono. Hay dos cargas negativas que se deslocalizan sobre los cuatro átomos de O (Fig. 5.2.4).
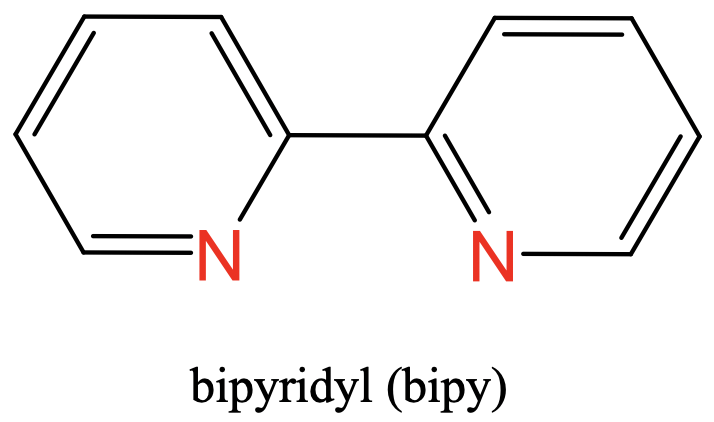
Como tercer ejemplo se puede ver el ligando bipiridilo que tiene dos átomos donadores de N como parte de dos anillos aromáticos. Los dos átomos de N están separados por dos átomos de carbono (Fig. 5.2.5).
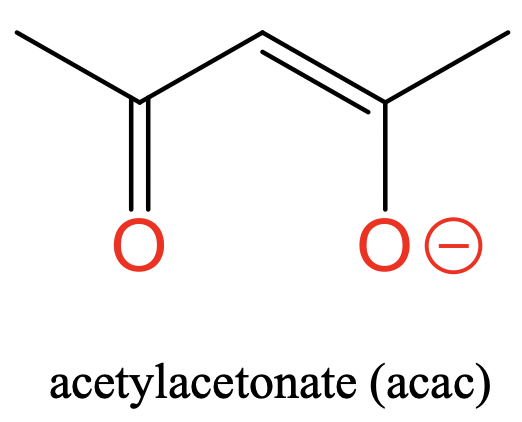
Por último, está el ligando acetil acetonato con dos átomos donadores de O separados por tres átomos de C (Fig. 5.2.6). El acetonato de acetilo lleva una carga negativa que se deslocaliza entre los dos átomos de O. En este caso los átomos donadores están separados por tres carbonos.
Los ligandos comunes a menudo tienen abreviaturas específicas. A menudo se utilizan en las fórmulas de compuestos de coordinación con estos ligandos. Por ejemplo, el ligando de etilendiamina se abrevia en, el ligando de oxalato se abrevia ox, el ligando bipiridilo se abrevia bipy y el ligando de acetil acetonato se abrevia acac. No solo hay ligandos bidentados con átomos donadores de O y N, sino también con otros como P y S.
Anillos en Complejos con Ligandos Quelatos
En la mayoría de los ligandos quelantes los átomos donadores están separados por otros dos o tres átomos, en su mayoría átomos de carbono. Esto se debe a que en este caso los ligandos quelatos pueden formar anillos de cinco y seis miembros con el ión metálico (Fig. 5.2.7).
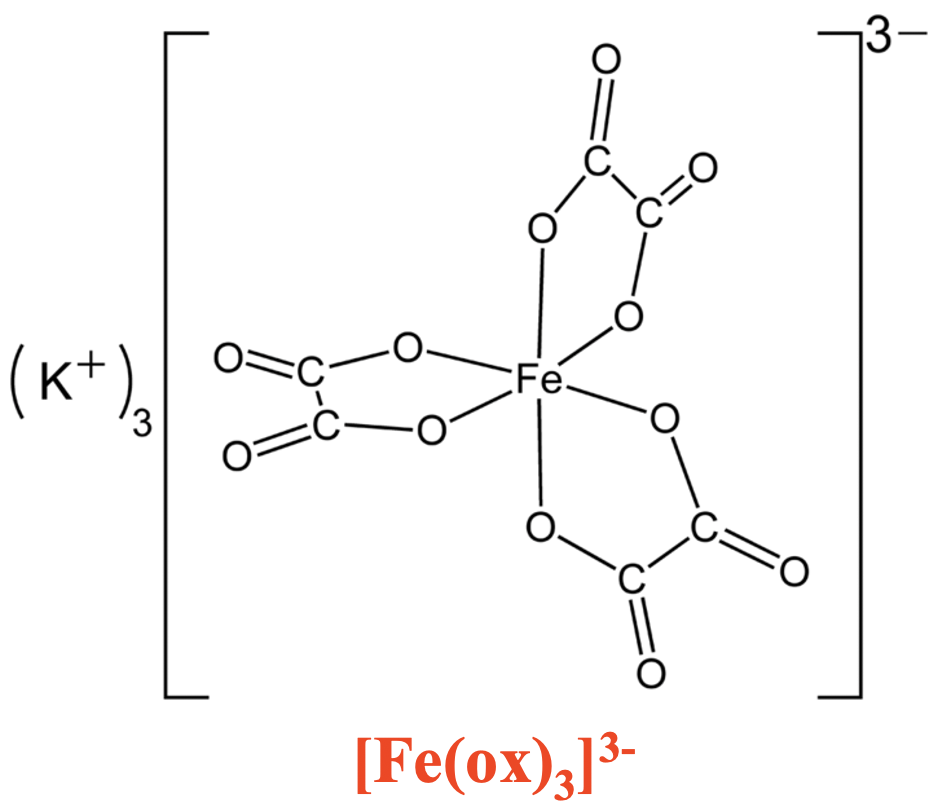
Se puede ver que el complejo trioxolato de hierro anterior tiene tres anillos de cinco miembros que contienen un átomo de Fe, dos O y dos átomos de C. Estos tamaños de anillo son particularmente estables porque tienen la menor tensión de anillo. Como consecuencia, los respectivos complejos de quelato son particularmente estables.
Ligandos tridentados
Aquí hay un par de ejemplos para ligandos tridentados.
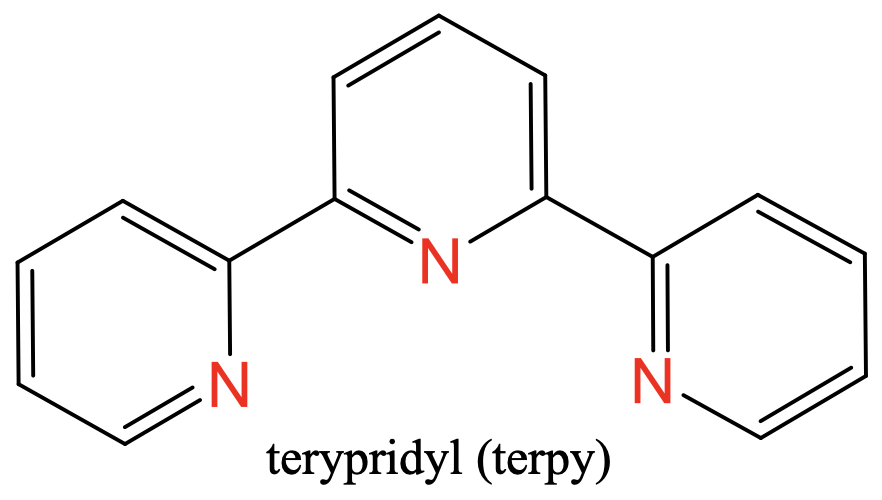
El primero es terpiridilo, abreviado “Terpy” (Fig. 5.2.8), el segundo es bisetilenetriamina, abreviado “tris” (Fig. 5.2.9).
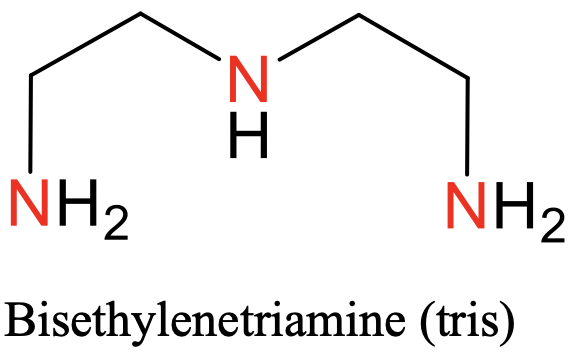
Ambos tienen tres átomos donadores de N separados por dos átomos de carbono. En el ligando “tris” hay dos grupos etileno entre los átomos de N, en el caso del ligando “terpy” los N-átomos forman parte de tres anillos aromáticos (Fig. 5.2.8. y Fig. 5.2.9)
Ligandos Tetradentados
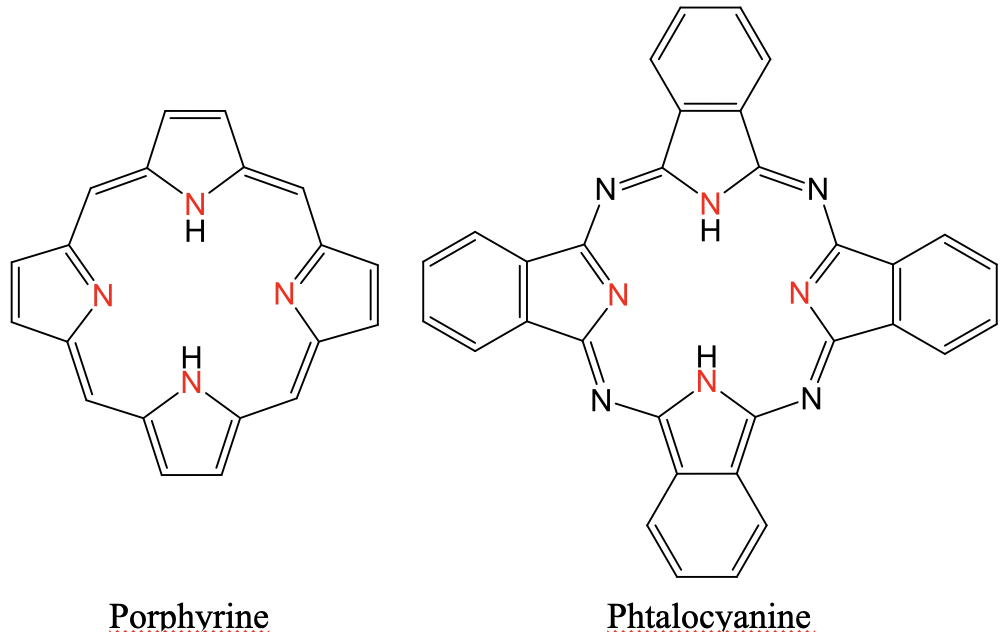
Dos ligandos tetradentados comunes son la porfirina y la ftalocianina (Fig. 5.2.9 y 5.2.10). Ambos se denominan ligandos macrocíclicos porque son ciclos grandes. Ambos tienen cuatro átomos donadores de N apuntando dentro del ciclo. El ligando de ftalocianina tiene cuatro átomos de N adicionales que conectan los anillos de cinco miembros a través de enlaces imina. Además, la ftalocianina tiene cuatro anillos de benceno fusionados a los cuatro anillos de cinco eslabones. El ligando porfirino es muy importante en los sistemas biológicos. Por ejemplo, es parte de la proteína hemoglobina. En este caso un ion Fe 2 + se asienta en el centro del anillo de porfirina. También es un componente de la clorofila en cuyo caso un ion Mg 2 + se asienta en el centro del anillo. Los ligandos de ftalocianina son importantes como componentes de los colorantes.
Ligando hexadentado, EDTA
Un ligando hexadentado muy común es el ligando del ácido etilendiamina tetraacético (EDTA). Se puede ver su estructura a continuación (Fig. 5.2.11).
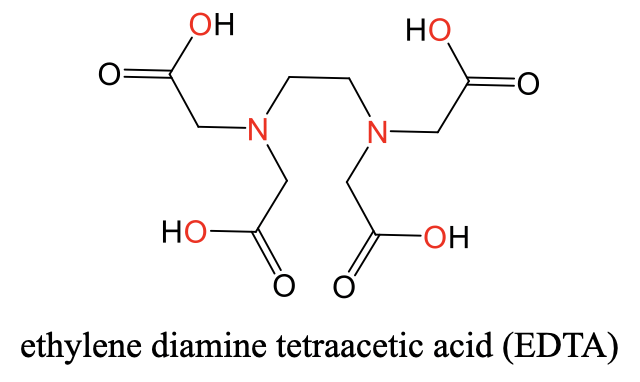
Tiene dos átomos donadores de N separados por un grupo etileno. Cada átomo de N está conectado además a dos grupos acetilo. Los cuatro grupos acetilo en general portan cuatro átomos donadores de O. En general, hay seis átomos donantes. Los seis átomos donantes pueden coordinarse octaédricamente a un ion metálico como un ion Ca 2 + (Fig. 5.2.12).
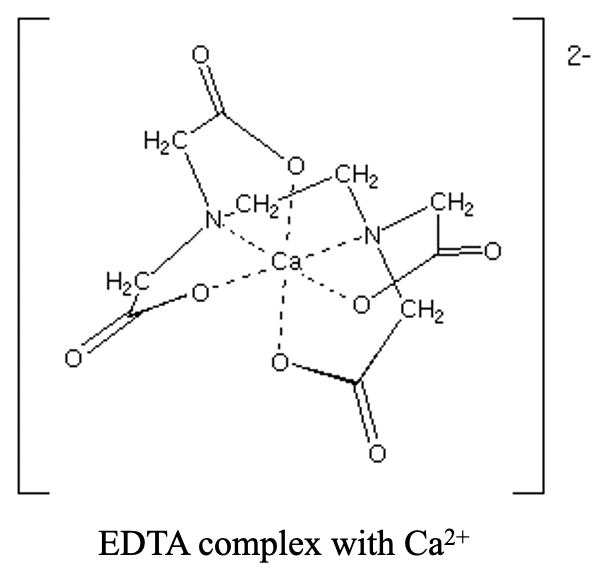
En forma coordinada el ligando EDTA es desprotonado, y los átomos donadores O llevan una carga negativa. Por lo tanto, un complejo EDTA con un catión divalente como Ca 2+ tiene una carga 2-.
Nomenclatura de Complejos
Ahora desarrollemos una nomenclatura para la química de coordinación para que podamos comunicarlos de manera educada. Un aspecto importante es que nombramos el número de ligandos. Para indicar el número de un ligando particular utilizamos prefijos griegos (Fig. 5.2.13).
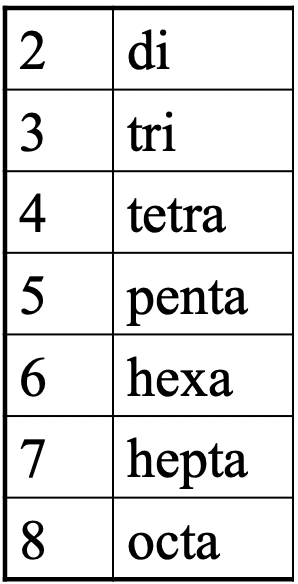
Estos son los mismos prefijos que conocimos cuando discutimos ligandos multidentados. Si hay dos ligandos usamos el prefijo di, si hay tres usamos el prefijo tri- y así cuarto.
Nomenclatura de Complejos con Esferas de Coordinación Aniónica
Ahora podemos desarrollar el nombre completo de un complejo de coordinación. Consideremos primero los compuestos con aniones complejos. Podemos nombrarlos de acuerdo a tres pasos.
En el primer paso nombramos el contracatión. No contabilizamos el número de contracationes en el nombre.
A continuación, determinamos el nombre y el número de ligandos. Si el ligando es aniónico obtiene el sufijo “o”. Tenga en cuenta que a veces para facilitar la pronunciación se utilizan abreviaturas. Por ejemplo, un Cl - es un ligando de cloro, y no un ligando de clorido. Debes memorizar estas formas más cortas. Generalmente, cuando un anión termina con “ide”, se omite el “ide”, y se sustituye por “o”.
El tercer paso es nombrar al ion metálico y agregar el sufijo “ate” al nombre. Puede agregar el número de oxidación del metal en números romanos o la carga del anión complejo entre paréntesis después del nombre del metal. La primera nomenclatura se denomina sistema “Stock”, este último el sistema “Ewing-Bassett”. Tenga en cuenta que si el símbolo del elemento del metal se deriva de un nombre latino entonces se usa el nombre latino. Por ejemplo, si la plata es el metal entonces el anión complejo es un argentino, si el plomo es el metal el anión complejo es un plomado. También aquí las abreviaturas se utilizan a menudo para facilitar la pronunciación. Si el nombre termina con “um” ese final se sustituye por “comió”.
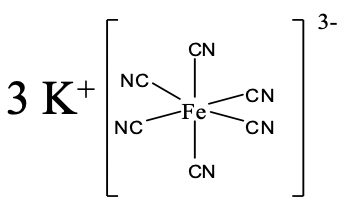
Un ejemplo para compuestos de coordinación con un anión complejo se muestra anteriormente (Fig. 5.2.14). ¿Cuál es su nombre? Hay tres cationes K +, por lo que el nombre comienza con potasio. Nos damos cuenta a continuación, que hay seis aniones cianuro como ligandos, por lo que el nombre continúa “hexacyano”. El nombre del metal es hierro, pero usamos el nombre latino ferrum, y reemplazamos el final “um” por el final “comió”. El número de oxidación del hierro es +3. Podemos ver eso por el hecho de que el ion complejo tiene una carga de 3, y los seis ligandos ciano tienen una 1 carga cada uno. Si usáramos el sistema Stock, por lo tanto, pondríamos los números romanos para +3 entre paréntesis detrás del nombre. Si usáramos el sistema Ewing-Bassett, colocaríamos el (3-) para la carga negativa del complejo detrás del nombre. Entonces en general sería un hexacianoferrato de potasio (III) o un hexacianoferrato de potasio (3-).
Ejercicios
¿Cómo nombrarías los siguientes dos compuestos?
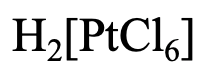
Veamos el primer ejemplo (Fig. 5.2.17). Primero, tenemos que nombrar el catión. ¿Qué es? Es sólo “hidrógeno”. A continuación tenemos que determinar el nombre y número de ligandos. Tenemos seis ligandos de cloro, por lo que el nombre continúa con “hexacloro”. El nombre del metal es platino. Sustituimos el final “um” por “comió”. En el sistema Stock el número romano sería (IV) porque el estado de oxidación del Pt es +4. Esto lo podemos ver por el hecho de que el anión complejo tiene una carga 2, y los seis ligandos cloro tienen una 1 carga cada uno. Debemos agregar +4 a -6 para llegar a -2. Por lo tanto, en el Sistema Stock, el nombre sería hexacloroplatinato de hidrógeno (IV), y en el sistema Ewing-Bassett sería hexacloroplatinato de hidrógeno (2-).
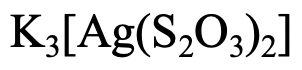
El segundo ejemplo (Fig. 5.2.18) tiene tres cationes K +, por lo que el nombre comienza con potasio. ¿Cuál es el nombre del ligando? El nombre del anión es tiosulfato. En este caso sustituimos la terminación “e” por la terminación “o”. Tenemos dos ligandos, por lo que es un “ditiosulfato”. El metal es plata, pero usamos el nombre latino “argentum”, y reemplazamos el final “um” por el final “ate”. Entonces es un “argentino”. La fusión de las partes juntas da “ditiosulfato de potasio argentato”. El número de oxidación de Ag es +1, la carga en el anión es -3. Entonces pon (I) en números romanos o 3- entre paréntesis detrás del nombre.
Nomenclatura de complejos con esferas de coordinación catiónica
Ahora nombremos complejos con cationes complejos. Nombramos primero el catión complejo, y luego el anión. Luego, determinamos el nombre y el número de los ligandos y prefijos en consecuencia. Si hay un ligando aniónico le damos de nuevo el sufijo “o”. Entonces, nombramos al metal. En este caso, siempre usamos nombres ingleses. Colocamos el número de oxidación en números romanos o la carga del catión complejo detrás del nombre, dependiendo de si queremos usar el sistema Stock o Ewing-Bassett.
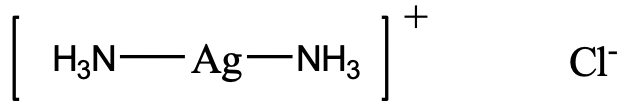
Por ejemplo, ¿cómo nombraría el complejo representado anteriormente (Fig. 5.2.19)? Hay dos ligandos NH 3 los cuales son neutros. Tenemos que considerar que NH 3 como ligando se llama ligando “amina”. Tenga en cuenta que se deletrea con dos “m” en el medio. Entonces el nombre empieza “diammine”. El nombre del metal es plata, y el estado de oxidación de la plata es +1. Esto se debe a que el complejo tiene una carga 1+ y los ligandos de amina son neutros. El anión es un anión cloruro.
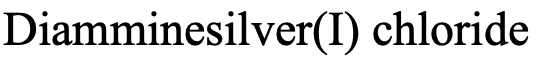
Por lo tanto, el nombre en el sistema Stock sería “cloruro diamminesilver (I) (Fig. 5.2.20).
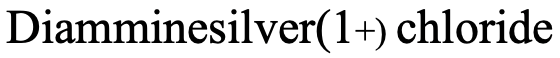
En el sistema Ewing-Bassett sería “cloruro Diamminesilver (1+)” (Fig. 5.2.21)
Ejercicios
Cuáles serían los nombres de los dos compuestos que se enumeran a continuación.
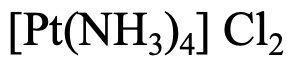
El primer ejemplo, Fig. 5.2.22, tiene cuatro ligandos NH 3, por lo que el nombre comienza con tetraamina. El platino es el metal, por lo que el nombre sigue siendo “platino”. El estado de oxidación de Pt es +2 porque el catión complejo tiene una carga 2+, y los ligandos son de carga neutra. El nombre del anión es “cloruro”. Por lo que en general es un “cloruro de tetraaminaplatino (II)” según el sistema Stock o un cloruro de “tetramminoplatino (2+) según el sistema Ewing-Bassett.
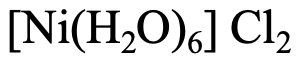
El segundo compuesto (Fig. 5.2.23) tiene seis ligandos de agua, por lo que el nombre comienza con “hexaaqua” seguido del nombre del metal con es “níquel”. El estado de oxidación del Ni es 2+ porque la carga en el catión complejo es +2, y los ligandos son de carga neutra. El nombre del anión es “cloruro”. Por lo tanto, el nombre es cloruro de hexaaaqua níquel (II) o cloruro de “hexaaquanickel (2+).
Nomenclatura de complejos con esferas de coordinación catiónicas y aniónicas
También existe la posibilidad de que un compuesto de coordinación esté hecho de un catión complejo y un anión complejo. En este caso, las reglas discutidas anteriormente sostienen, lo único nuevo que hay que aprender es que nombramos primero al catión complejo y al anión complejo en segundo lugar.
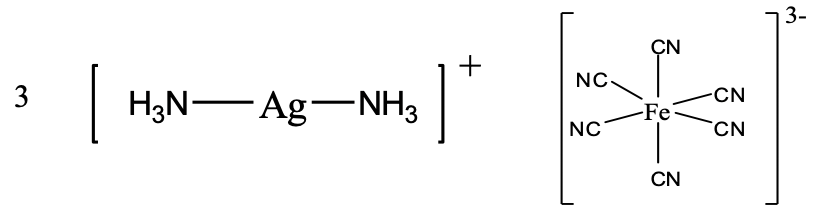
En el compuesto representado (Fig. 5.2.24) tenemos un catión diammina-plata (I) y un anión hexacianoferrato (III).
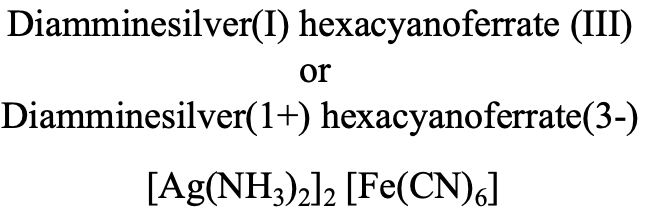
De ahí el nombre es diammina plata (I) hexacianoferrato (III) en el sistema Stock o diammina plata (1+) hexacianoferrato (3-), Fig. 5.2.24.
Nomenclatura de Complejos con Más de un Ligando del Mismo Tipo
¿Y si hay diferentes ligandos en un compuesto de coordinación? En este caso, nombramos los ligandos en orden alfabético, y le damos a cada ligando un prefijo según su número.
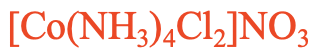
Por ejemplo: ¿Cuál es el nombre de [Co (NH 3) 4 Cl 2] NO 3, Fig. 5.2.26? Este es un compuesto con un catión complejo que contiene ligandos de amina y cloro. Debido a que “a” viene antes que “c” en el alfabeto tenemos que nombrar primero al ligando de amina. Hay cuatro ligandos de amina y dos ligandos de cloro. Por lo tanto, utilizamos los prefijos “tetra” frente a “ammine” y “di” frente a “cloro”. Entonces el nombre comienza “tetraamminedicloro”. Entonces, nombramos al metal que es cobalto. El número de oxidación del cobalto es +3 porque hay cuatro ligandos de amina neutra de carga, dos ligandos clorados aniónicos, y la carga en el catión complejo es +1. +3 -2 = +1. Entonces en el sistema Stock el compuesto se llama nitrato de tetramminodiclorocobalto (III), en el sistema Ewing-Basset se llama nitrato de tetramminodiclorocobalto (1+).

Hagamos un ejemplo más, Fig. 5.2.27. En el compuesto [Pt (NH 3) BrCl (H 2 O)] SO 4 hay un catión complejo con cuatro ligandos diferentes: un ligando “amina”, un ligando “bromo”, un ligando “cloro” y un ligando “aqua”. ¿Cuál es el orden de ellos? Según el alfabeto, “ammine” viene primero, “aqua” es segundo, “bromo” es tercero, y “cloro” es cuarto. No reciben prefijo porque solo hay uno de ellos para cada uno. El metal es platino, y su estado de oxidación es +4 porque el catión complejo tiene una carga 2+, y hay dos ligandos neutros, a saber, los ligandos aqua y amina, y dos aniónicos, a saber, los ligandos bromo y cloro: +4 - 2 = +2.

Por lo tanto, el nombre es amminaaquabromocloroplatino (IV) sulfato en el sistema Stock, y amminaaquabromocloroplatino (2+) sulfato en el sistema Ewing-Bassett, 5.2.28.
Nomenclatura de Complejos con Ligandos Complicados en una Esfera de Coordinación
Hasta ahora solo consideramos ligandos relativamente simples que eran o bien monoatómicos, o contenían solo unos pocos átomos. Sin embargo, muchos ligandos, en particular ligandos quelantes, contienen más átomos y tienen nombres más complejos. Estos nombres ya pueden contener prefijos que usamos para numerar ligandos. Por ejemplo el ligando etilendiamina es un ligando quelante con un nombre más largo que ya contiene el prefijo “di”. En tales casos, para evitar ambigüedades, ponemos el nombre del ligando entre paréntesis, y colocamos un prefijo algo diferente frente a él para dar cuenta del número de los ligandos.

En lugar de “di” usamos “bis”, en lugar de “tri” usamos “tris”, en lugar de “tetra” usamos “tetrakis”, en lugar de “penta” usamos “pentakis”, y así sucesivamente, Fig. 5.2.29.
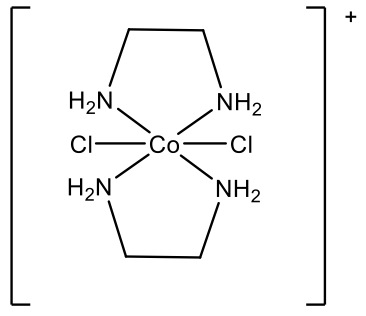
Por ejemplo, ¿cuál es el nombre del catión complejo representado anteriormente (Fig. 5.2.30)? Primero debemos darnos cuenta de que hay dos ligandos diferentes: ligandos cloro y ligandos etilendiamina. Necesitamos nombrar primero a los ligandos de cloro, porque vienen primero en el alfabeto. Debido a que hay dos ligandos de cloro usamos el prefijo “di”. El ligando etilendiamina se coloca entre paréntesis, y se usa el prefijo “bis” en lugar de “di”. El metal es cobalto en estado de oxidación +3 porque el catión complejo tiene una carga 1+, y hay dos ligandos cloro con una carga 1 cada uno, y dos ligandos de etilendiamina de carga neutra: +3 -2 = +1.

Por lo tanto, el nombre es diclorobis (etilendiamina) cobalto (III) en el sistema Stock y diclorobis (etilendiamina) cobalto (1+) en el sistema Ewing-Bassett (Fig. 5.2.31).
Nomenclatura de Complejos con Ligandos de Puente
Los ligandos no solo pueden ser terminales, también pueden puentear dos centros metálicos. Para indicar que un ligando es un ligando puente le damos un prefijo μ. Los ligandos puente se nombran antes que los ligandos terminales, y el nombre de los fragmentos moleculares con los ligandos terminales y los iones metálicos se coloca entre paréntesis después del nombre del ligando puente.
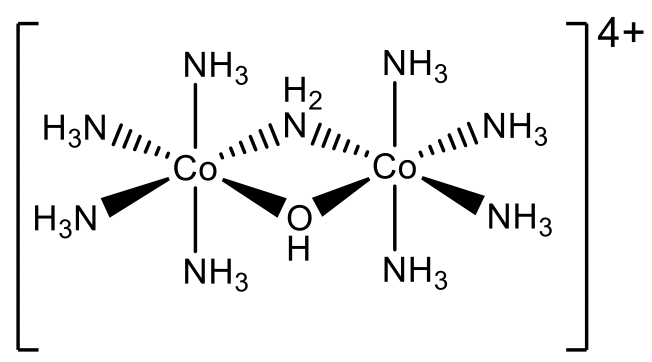
Entonces, ¿cuál es el nombre del catión complejo representado anteriormente (Fig. 5.2.32)? Podemos ver que hay dos ligandos puente diferentes, uno es un hidroxo-ligando OH -, y el otro se llama ligando amido NH 2 -. Estos ligandos puente unen dos fragmentos moleculares idénticos que contienen un átomo de Co y cuatro ligandos de amina cada uno. Los dos ligandos puente necesitan ser nombrados primero, y tenemos que nombrarlos de acuerdo con el orden alfabético. De ahí que el nombre comience “μ -amido- μ -hidroxo”. Entonces, tenemos que nombrar los dos fragmentos que están puenteados. Debido a que hay un Co y cuatro ligandos NH 3, el nombre del fragmento es “tetraamminecobalt”. Debido a que este es un nombre más complejo necesitamos ponerlo entre paréntesis. Hay dos fragmentos, por lo tanto necesitamos usar el prefijo “bis”. El estado de oxidación del Co es +3. Esto se debe a que hay dos ligandos aniónicos, el hidroxo y el ligando amido que tienen ambos una carga 1-. Los otros ligandos son neutros. El catión complejo lleva una carga 4+: +6-2=+4. Debido a que hay dos átomos de Co, tienen un número de oxidación de +6/2=+3.

De ahí que el nombre general según el sistema Stock es “μ -amido- μ -hidroxobis (tetraamminecobalt) (III)”, Fig. 5.2.33.

En el sistema Ewing-Bassett es μ -amido- μ -hidroxobis (tetraamminecobalt) (4+), Fig. 5.2.34. Ahora hemos concluido el capítulo sobre nomenclatura.


