5.4: Isomería
- Page ID
- 70270
Esta sección será sobre isomería en compuestos de coordinación. Es posible que ya conozcas isomerismo de tus clases de química orgánica. Aquí, aplicaremos el isomería a la química de coordinación. Algunas formas de isomería en química orgánica y de coordinación son las mismas, pero hay algunas formas de isomería que solo ocurren en la química de coordinación.
Primero revisemos brevemente la definición de isomería: Isomería es cuando dos o más compuestos tienen fórmulas empíricas idénticas pero estructuras diferentes.
Definición: Isomería
Cuando dos o más compuestos tienen fórmulas empíricas idénticas pero estructuras diferentes se denominan isómeros.
Distinguimos entre dos tipos básicos de isomerismos: Isomería constitucional y estereoisomería. ¿Cuál es la diferencia? En el isomerismo constitucional los enlaces no se encuentran entre los mismos átomos.
Definición: Isómeros constitucionales
En los isómeros constitucionales los enlaces no están entre los mismos átomos.
En el estereoisomerismo, los enlaces se encuentran entre los mismos átomos, pero los ligandos están en diferentes sitios de coordinación.
Definición: Estereoisómeros
En los estereoisómeros, los enlaces están entre los mismos átomos, pero los ligandos están en diferentes sitios de coordinación.
Formas de isomería constitucional
Isomería del hidrato
Primero, veamos más de cerca el isomerismo de los hidratos. En el isomerismo de hidrato, en un isómero un ligando de agua está en la primera esfera de coordinación, y en el otro isómero está en la segunda esfera de coordinación. Una molécula de agua en la segunda esfera de coordinación solo se define para el estado sólido, pero no en solución. Esto se debe a que en solución la molécula de agua pasaría a formar parte del disolvente. Aquí hay algunos ejemplos de isómeros de hidrato.
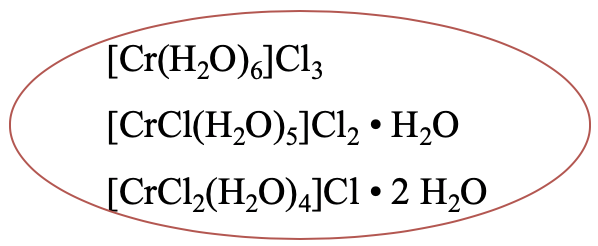
En el complejo [Cr (H 2 O) 6] Cl 3 hay seis ligandos aqua en la primera esfera de coordinación (Fig. 5.4.1). En un isómero hidrato, solo hay cinco moléculas de agua en la primera esfera de coordinación, la sexta está en la segunda esfera de coordinación. Un anión cloruro ha pasado de la segunda a la primera esfera de coordinación. Existe un tercer isómero hidrato que tiene cuatro ligandos aqua en la primera esfera de coordinación y dos moléculas de agua en la segunda esfera de coordinación. Dos ligandos de cloro se encuentran ahora en la primera esfera de coordinación y uno en la segunda esfera de coordinación. Teóricamente serían posibles más isómeros de hidrato, pero por alguna razón la naturaleza no los hace.
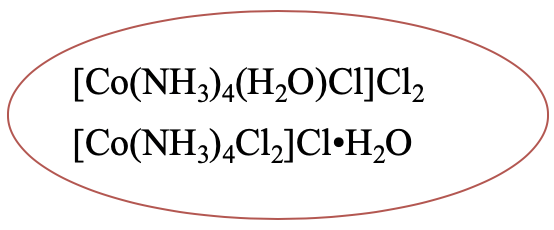
Otro ejemplo es [Co (NH 3) 4 (H 2 O) Cl] Cl 2. Tiene un isómero hidrato en el que un ligando aqua se ha movido a la segunda esfera de coordinación, y un anión cloruro se ha movido de la segunda a la primera esfera de coordinación (Fig. 5.4.2).
Isomería de ionización
Una segunda forma de isomería es el isomerismo de ionización. En este caso un ion se mueve de la primera a la segunda esfera de coordinación y/o viceversa.

Por ejemplo, en el compuesto [Co (NH 3) 5 NO 3] SO 4 hay un ion nitrato en la primera esfera de coordinación, y un ion sulfato en la segunda esfera de coordinación (Fig. 5.4.3). Existe un isómero de ionización en este compuesto, en el que el ion sulfato se encuentra ahora en la primera esfera de coordinación, y el nitrato está en la segunda esfera de coordinación.
Isomería de Coordinación
Otra forma de isomería constitucional es el isomerismo de coordinación. En este isomerismo, los ligandos se unen a diferentes iones metálicos. Naturalmente, esto implica que esta forma de isomería solo puede existir si al menos un isómero tiene dos iones metálicos distinguibles.
Por ejemplo, el compuesto Pt (NH 3) 2 Cl 2 tiene dos isómeros de coordinación diferentes. A primera vista, no parecen ser isómeros en absoluto. Sin embargo, podemos verificar que tienen la misma fórmula empírica que el primer compuesto (Fig. 5.4.4).
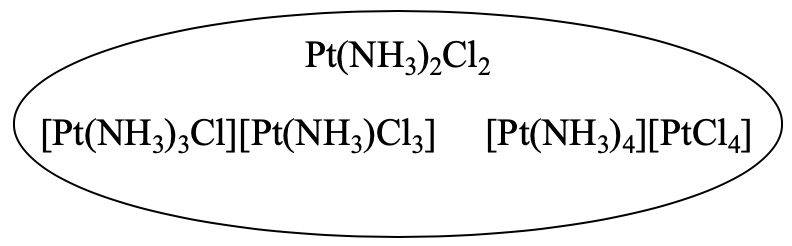
[Pt (NH 3) 3 Cl] [Pt (NH 3) Cl 3] tiene dos átomos de Pt, cuatro unidades NH 3 y cuatro átomos de Cl. Eso hace que Pt 2 (NH 3) 4 Cl 4. Esta fórmula se puede dividir por 2 para dar Pt (NH 3) 2 Cl 2. Ahora podemos ver fácilmente que los dos compuestos son isómeros. El tercer isómero también tiene dos átomos de Pt, cuatro unidades NH 3 y cuatro átomos de cloro, por lo que también debe ser un isómero.
¿Por qué son isómeros de coordinación? Esto se debe a que en el primer complejo todos los ligandos están unidos al mismo átomo metálico, mientras que en los otros dos los ligandos están unidos a diferentes átomos metálicos. En estos compuestos, un átomo de Pt pertenece a un catión complejo, y el otro a un anión complejo. En el segundo isómero, tres ligandos de amina y un ligando de cloro están unidos al primer átomo de Pt, y uno de amina y tres ligandos de cloro están unidos al segundo átomo de Pt. En el tercer isómero, cuatro ligandos de amina están unidos al primer átomo de platino, y cuatro ligandos de cloro pertenecen al segundo átomo de platino.
El isomerismo de coordinación también es posible para iones metálicos de diferentes elementos.
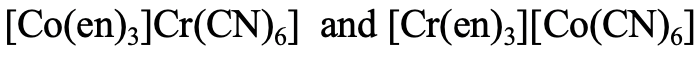
En el ejemplo mostrado (Fig. 5.4.5), el primer isómero tiene etilendiamina unida a Co y cianuro unido a Cr, mientras que en el segundo isómero etilendiamina está unida a Cr y el ligando ciano está unido a Co.
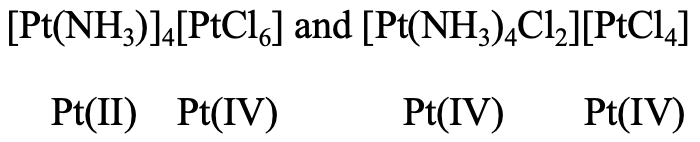
Además, en los isómeros de coordinación, los iones metálicos pueden estar en diferentes estados de oxidación. Podemos ver que en los dos isómeros representados hay cationes complejos, y aniones complejos con Pt en diferentes estados de oxidación (Fig. 5.4.6). En el primer isómero Pt (II) hace que el catión complejo tenga cuatro ligandos amínicos unidos a él. Pt (IV) es parte del anión complejo que está rodeado por seis ligandos de cloro. En el segundo isómero, Pt (IV) forma el catión complejo que tiene cuatro ligandos amina y dos cloro en la primera esfera de coordinación, y Pt (II) forma el anión complejo que tiene cuatro ligandos cloro.
Isomería de enlace
El isomerismo de ligamiento, también llamado isomería ambidentado, es un isomerismo que se puede observar para ligandos que tienen más de un extremo reactivo. En dos isómeros de enlace, los ligandos se unirán con diferentes extremos al metal. El extremo reactivo depende de las interacciones efectivas HOMO-LUMO. Los átomos donantes blandos tienden a unirse a metales blandos, y los átomos donadores duros tienden a unirse a metales duros. También el solvente puede jugar un papel importante.
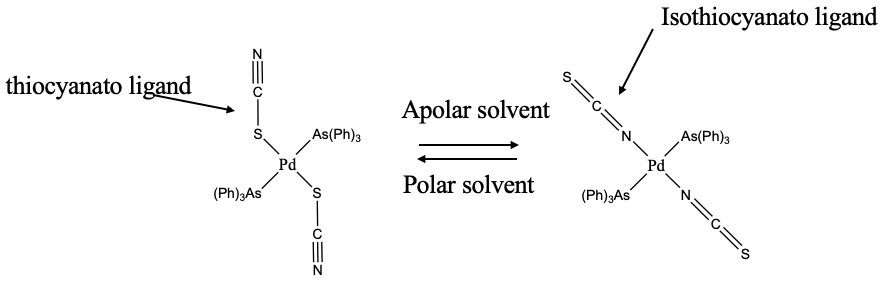
Un ejemplo de un ligando ambidentado es el anión tiocianato (Fig. 5.4.7). Puede unirse ya sea con el azufre o con el extremo nitrógeno a un ion metálico. Cuando se une con el extremo S se le llama el tiocianato-ligando, cuando se une con el extremo N se le llama ligando isotiocianato. Qué átomo se une al metal puede depender del disolvente. En el ejemplo mostrado, el tiocianato se une con S a Pd en disolventes polares, pero con N en disolventes apolares. Podríamos tratar de racionalizar por qué. Una posibilidad es que en disolventes polares el átomo de N más electronegativo pueda participar en enlaces de hidrógeno, lo que no es posible en disolventes apolares. Los argumentos estéricos también podrían jugar un papel. Se puede ver que los ligandos de trifenilarsina son bastante voluminosos. Cuando el ligando se une con el nitrógeno, entonces se une de manera lineal evitando la interferencia estérica con uno de los ligandos de arsina. Por lo que puede ser que en disolventes apolares las interacciones estéricas dominen el comportamiento, mientras que en disolventes polares las interacciones solvente-ligando están en control.
Incluso es posible que dos ligandos ambidentados iguales se unan con extremos opuestos al metal en una y la misma molécula.
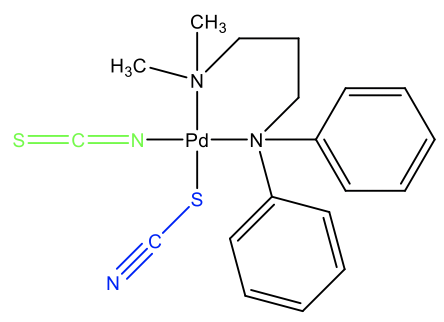
Un ejemplo es el complejo mostrado (Fig. 5.4.8). En esta molécula, hay un tiocianato y un ligando isocianato que se unen a Pd. ¿Qué argumentos tendríamos para explicar este isomería ambidentado? Piénsalo por un momento. Podemos ver que los dos grupos metilo son mucho menos voluminosos que los dos grupos fenilo. Cuando el tiocianato se une con el átomo S, entonces puede doblarse lejos de los dos grupos fenilo voluminosos. El segundo anión tiocianato se une con el átomo de N porque no hay interferencia significativa entre los grupos metilo y el ligando isotiocianato lineal. Este comportamiento indica que termodinámicamente, la interacción Pd-N es más fuerte, pero solo un poco más fuerte porque otros factores como la interferencia estérica pueden revertir fácilmente el comportamiento.
Los ligandos tío e isotiocianato no son los únicos ejemplos de ligandos ambidentados.
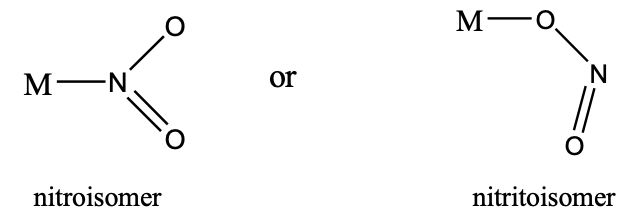
Otro ejemplo es el anión nitrito. Se puede unir con el extremo N o el extremo O a un metal. En el primer caso se le llama nitroisómero, en este último se le llama isómero nitrito (Fig. 5.4.9). Los nitritoisómeros suelen ser más estables.
Estereoisómeros (isómeros de configuración)
Ahora vamos a discutir el segundo tipo importante de isomería: el estereisomerismo. Como se mencionó anteriormente, en el estereoisomería los enlaces se encuentran entre los mismos átomos, pero las posiciones en las que se unen los ligandos, los sitios de coordinación, son diferentes. Existen dos tipos básicos de estereoisomería: diastereomerismo y enantiomerismo (Fig. 5.4.10).
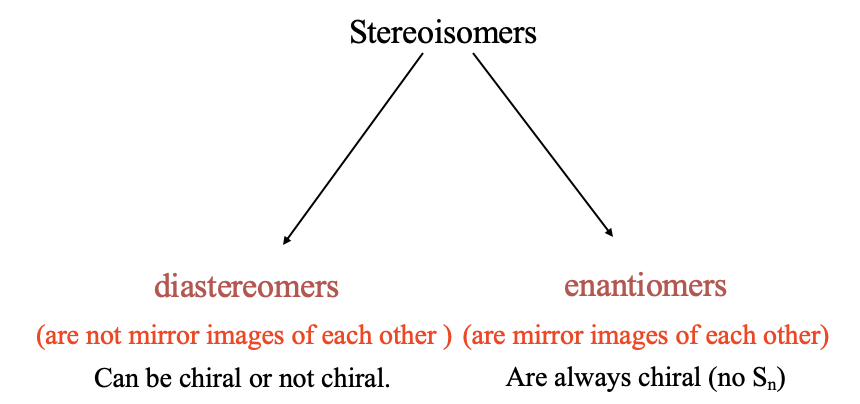
En diastereomerismo, los diastereómeros no son imágenes especulares entre sí.
Definición: Diastereómeros
Los diastereómeros son estereoisómeros que no son imágenes especulares entre sí. Pueden ser quirales o no quirales.
En el enantiomerismo, los enantiómeros son imágenes especulares entre sí. Los enantiómeros son siempre moléculas quirales.
Definición: Enantiómeros
Estereoisómeros que son imágenes especular entre sí. Siempre son quirales.
Los diastereómeros pueden ser quirales, pero no tienen que ser quirales. Recuerde, una molécula es quiral cuando no tiene un eje rotacional inadecuado.
Ejemplo - Diastereómeros y Enantiómeros
Tomemos un ejemplo de la química orgánica para ilustrar la diferencia entre enantiomerismo y diastereomerismo.
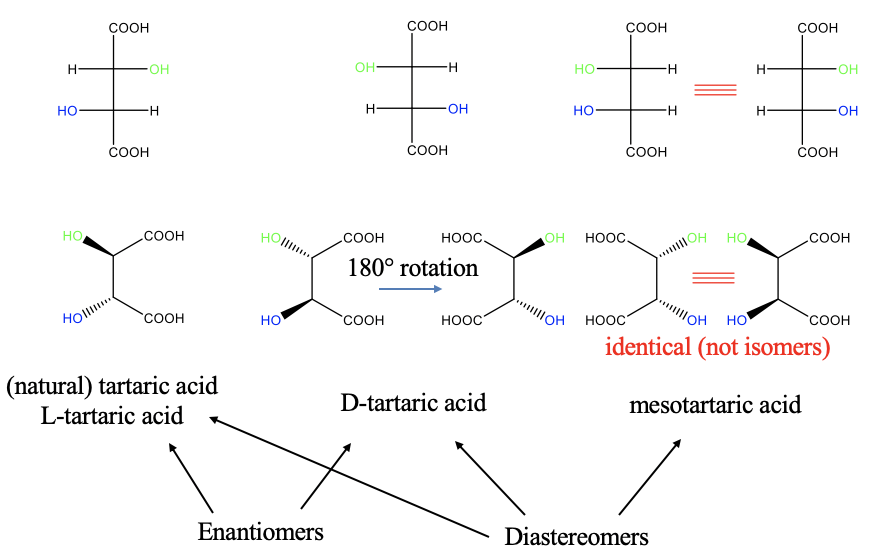
Arriba (en la parte superior izquierda de la Fig. 5.4.11) se ve la proyección de Fischer un isómero de un compuesto llamado ácido tartárico, se llama ácido L-tartárico. El primer grupo OH desde los puntos altos hacia la izquierda, y el segundo apunta a la derecha. Esta es la forma natural del ácido tartárico. La estructura real del ácido L-tartárico se representa a continuación (abajo a la izquierda). Se puede ver el grupo OH que apunta a la derecha en la proyección de Fischer apunta hacia nosotros, mientras que el otro, que apunta a la izquierda en la proyección Fischer, apunta lejos de nosotros.
En el isómero del ácido D-tartárico, el primer grupo OH en la proyección de Fischer apunta a la izquierda y el segundo apunta a la derecha. Para la estructura real esto significa que el primer grupo OH apunta lejos de nosotros, y el segundo apunta hacia nosotros. Estos dos isómeros son imágenes especulares entre sí, y por lo tanto son enantiómeros. Es posible que no veas inmediatamente en la estructura real que las dos son imágenes especulares, pero puedes verla cuando rotas la molécula alrededor del eje del enlace C-C para que los grupos ácido carboxílico apunten hacia la izquierda (Fig. 5.4.11). ¿Ya lo ves?
Existe un tercer isómero que es el llamado ácido mesotartrárico. Podemos dibujar su proyección Fischer con ambos grupos OH apuntando hacia el lado derecho (Fig. 5.4.11). En la estructura real ahora ambos grupos hidroxo apuntan al frente. ¿Es esta molécula una imagen especular de una de las dos moléculas anteriores? ¡No, no lo es! Por lo tanto, es un diastereómero relativo a los otros dos. A primera vista parece que podemos dibujar otra molécula que es la imagen especular del ácido mesotatrárico. Tendría dos grupos hidroxo apuntando a la izquierda en la proyección Fischer, y dos grupos hidroxo apuntando lejos de nosotros en la estructura real. Sin embargo, las dos moléculas se pueden rotar para que se superpongan, y por lo tanto no son isómeros, sino moléculas idénticas.
Isomería cis-trans
Hablemos ahora de algunas formas comunes de estereoisomería. El isomerismo cis-trans es un estereoisomería muy común. Ocurre cuando dos, mismos ligandos están en posiciones adyacentes u opuestas. Por ejemplo, en un complejo plano cuadrado dos ligandos pueden estar adyacentes o en posiciones opuestas. Cuando está en posición adyacente, el ángulo de enlace es de 90° y tenemos un isómero cis, cuando está en posición opuesta, el ángulo de enlace es de 180° y tenemos un isómero trans.
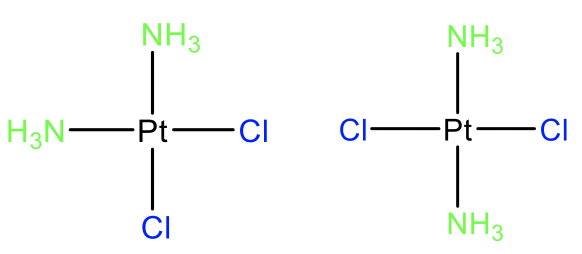
El ejemplo probablemente más conocido de isómero cis en química de coordinación es el cis-platino que es un fármaco anticancerígeno (Fig. 5.4.12). Sus isómeros trans no tienen estas propiedades farmacéuticas, lo que demuestra que el isomerismo cis-trans puede tener un profundo impacto en las propiedades de una molécula. El isomerismo cis-trans general en los complejos Pt (II) se ha estudiado con mayor intensidad, pero el isomerismo cis-trans también es conocido por otros iones metálicos d 8 en complejos planos cuadrados. También podemos preguntar si los isómeros cis y trans son diastereómeros o enantiómeros. Veamos el ejemplo del cis- y el trans-platino para responder a esta pregunta. Claramente, estos dos isómeros no son imágenes especulares entre sí, por lo que deben ser diastereómeros. Generalmente, los isómeros cis y trans son diastereómeros.
El isomerismo cis-trans se extiende más allá de los complejos planos cuadrados, y también es conocido por otras formas, por ejemplo, la forma bipiramidal trigonal y la forma octaédrica. En el isómero cis de un complejo octaédrico dos ligandos ocupan posiciones en la misma cara del octaedro, mientras que en el isómero trans ocupan posición opuesta al octaedro.
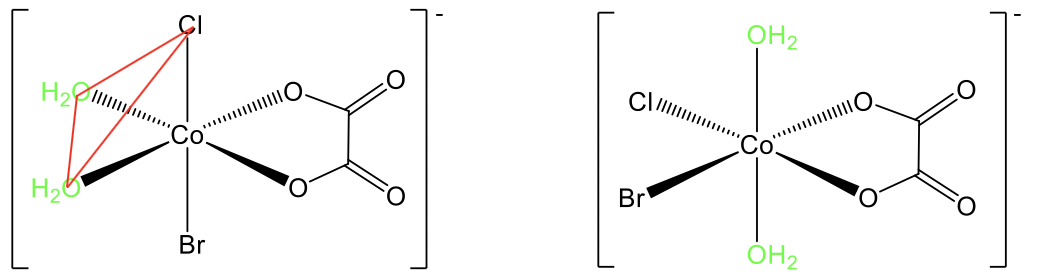
Por ejemplo, en el complejo diaquabromoclorooxalato cobalto (1-) se conocen isómeros cis y trans (Fig. 5.4.13). En el isómero trans los dos aqua-ligandos se encuentran en posición opuesta, y hay un ángulo de 180° entre ellos. En el isómero cis están en posición adyacente, y el ángulo es de 90°. Podemos ver que los dos ligandos están en la misma cara triangular del octaedro, que se muestra en rojo.
¿Hay reglas que nos puedan ayudar a decidir si se formará un complejo cis o trans? Como se podría sospechar, los ligandos más grandes suelen ir en posición trans debido a argumentos de repulsión estérica. Los ligandos bidentados generalmente forman el isómero cis porque los ligandos bidentados generalmente se diseñan para formar anillos de cinco o seis miembros con el ión metálico. ¿Los isómeros cis-trans son quirales? Si los ligandos son simples, entonces generalmente no lo son, pero si son más complicados, entonces pueden serlo. En este contexto hay que decir que rara vez se observan estructuras ideales. Por ejemplo, un complejo plano cuadrado rara vez es un plano cuadrado ideal, por ejemplo, porque los ángulos de enlace pueden estar algo distorsionados desde el ángulo de 90° debido al hecho de que los ligandos tienen requisitos estéricos desiguales. Una ligera distorsión en realidad puede eliminar uno o muchos elementos de simetría, lo que lleva a la quiralidad, sin embargo, tales pequeñas desviaciones generalmente se ignoran.
Isomería FAC-Mer
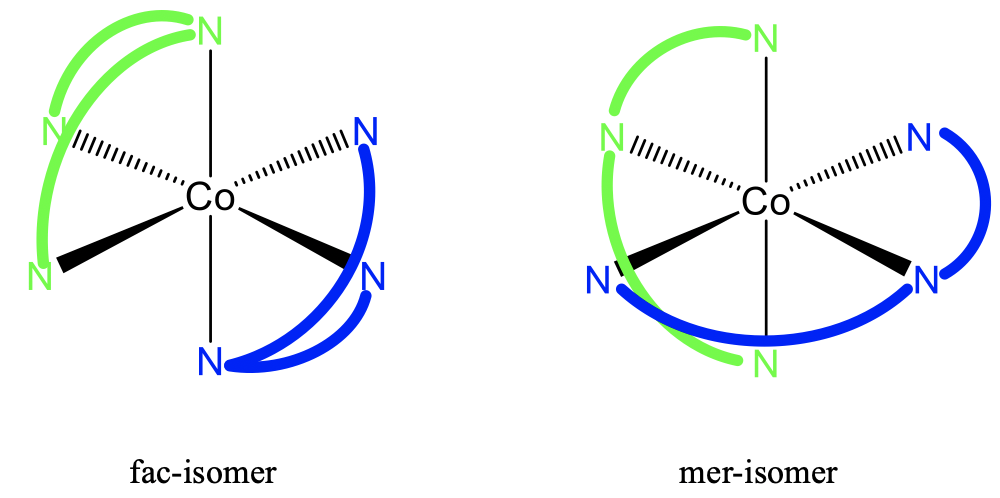
Otro tipo común de estereoisomería en la química de coordinación es el isomerismo fac-mer. Fac significa facial y mer significa meridional. En un fac-isómero los mismos ligandos están en una cara común de un complejo poliédrico, en el isómero mer están en un plano que biseca el poliedro. Este tipo de isomería es muy común para los complejos octaédricos, pero no se restringe a esos.

Por ejemplo, el complejo triammina triclorocobalto (III) tiene un isómero fac y un mero. Se puede ver que en el fac-isómero los ligandos idénticos están en dos caras triangulares opuestas del octaedro. En los isómeros meros se encuentran en dos planos que bisectan el octaedro. Podemos volver a preguntar si son diastereómeros o enantiómeros? La respuesta es: No son imágenes especulares entre sí, por lo que no son enantiómeros, sino diastereómeros.
Isomería FAC-Mer con Ligandos Tridentados
El isomerismo FAC-Mer también es común para los complejos octaédricos con ligandos tridentados, por ejemplo el ligando dietilentriamina (Fig. 5.4.15).
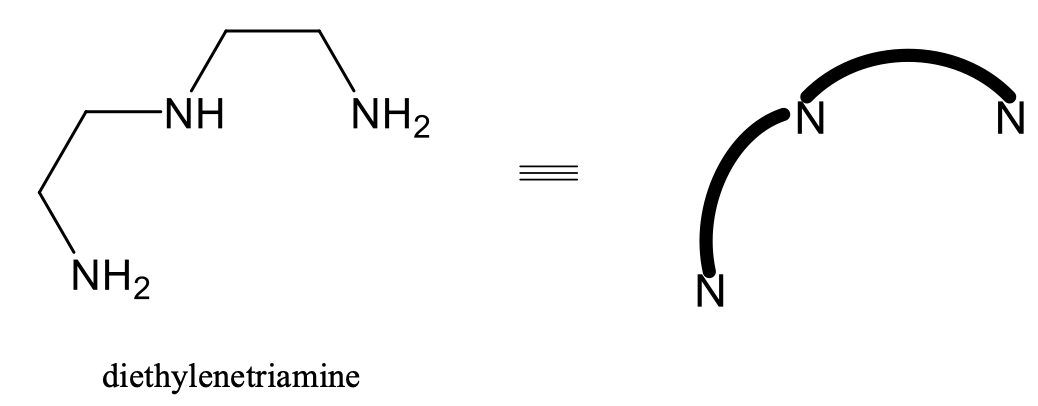
En este ligando dos grupos NH 2 y un grupo NH están interconectados por dos unidades de etileno. Por razones de claridad, en complejos con este ligando, a menudo solo se representa el átomo donador de N de los grupos NH 2 y NH, y las unidades de etilendiamina se simplifican como líneas dobladas que interconectan los átomos de N. Utilizaremos esta simplificación en lo siguiente (Fig. 5.4.16).
Aquí hay un ejemplo de complejos de bis (dietilentriamina) cobalto que son isómeros fac-meros (Fig. 5.4.16). Un ligando de etilendiamina se muestra en verde, el otro se muestra en azul. Se puede ver que el isómero izquierdo es el fac-isómero con los tres átomos donantes de un ligando colocados en la misma cara del octaedro. En el lado derecho se encuentra el isómero mer, con todos los átomos donantes del mismo ligando colocados en planos que bisectan el octaedro. También en este caso los dos isómeros no son imágenes especulares y son diastereómeros entre sí.
Complejos de trietilentetramina
Existe isomerismo similar al isomerismo fac-mero en complejos octaédricos con el ligando tetradentado trietilentetramina (Fig. 5.4.17).
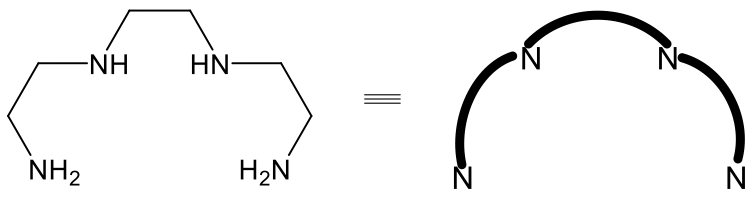
En este ligando, dos grupos NH y dos NH 2 están puenteados por cuatro grupos etileno. Podemos representar nuevamente el ligando de manera simplificada simplemente mostrando los átomos donadores de N, y simplificando los grupos etileno como líneas dobladas.
Una posibilidad para realizar un complejo octaédrico con ligandos de trietilentetramina es orientar los tres anillos en un mismo plano, también podemos decir que tenemos un complejo octaédrico con tres anillos coplanares. Esto se muestra a continuación (Fig.5.4.18).
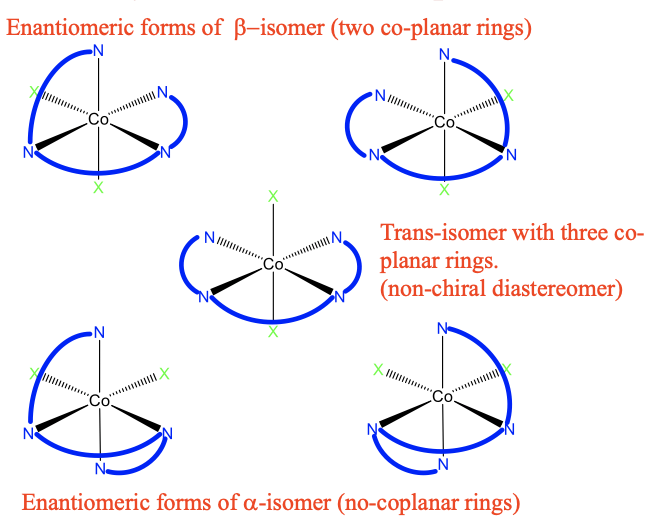
Las tres unidades de etilendiamina forman tres anillos de cinco miembros que son coplanares entre sí. Los átomos de N ocupan en general cuatro vértices del octaedro. Hay otros dos ligandos genéricos X ubicados en vértices opuestos del octaedro. Por lo tanto, este isómero se denomina isómero trans.
Podemos preguntar si esta molécula es quiral? La respuesta es no, porque hay un plano espejo que es coplanario con los tres anillos de cinco miembros. Además de este isómero trans, también hay dos isómeros cis, uno se llama isómero α, el otro se llama isómero β. En el isómero β, ahora solo hay dos anillos coplanares, el tercero ahora está fuera de plano. Los dos ligandos X están en posición cis uno con relación al otro. ¿El isómero trans es un diastereómero o enantiómero al isómero β? Claramente no son imágenes especulares entre sí, por lo tanto, deben ser diastereómeros. ¿Este isómero β es quiral? ¡Sí, lo es! No hay un eje de rotación incorrecto. Por lo tanto, debe existir un enantiómero, y este enantiómero debe ser una imagen especular de la forma β. ¡Aquí está! Naturalmente, también debe tener dos anillos coplanares, y dos ligandos X en posición cis. Por lo tanto, también se considera un isómero β.
Ahora vamos a discutir el α -isomería. En un isómero α ya no hay dos ligandos coplanares. Este isómero es un diastereómero a la forma trans y β porque los isómeros no son imágenes especulares. También el isómero α es quiral. Por lo tanto, debe haber otro isómero α que es la imagen especular del primer isómero α. Se muestra en la parte inferior derecha de la Figura 5.4.18.
Nomenclatura para Complejos de Hélices
Los complejos con dos o más anillos no coplanares que no son adyacentes son siempre quirales y se denominan “complejos de hélice”. Existe una nomenclatura especial para los complejos de hélices que discutiremos brevemente a continuación.
Primero entendamos por qué estos complejos son complejos de hélices? Se les llama así porque los anillos no coplanares están orientados uno respecto al otro de manera similar a las palas de las hélices. Una hélice debe tener al menos dos palas, pero también puede tener más que eso. Distinguimos entre las llamadas hélices zurdas y hélices diestras. Una hélice zurda tiene la propiedad de alejarse de usted en un medio como el aire o el agua cuando se gira en sentido antihorario.
Definición: Hélice para zurdos
La rotación en sentido contrario a las agujas del reloj mueve una hélice izquierda
Una hélice diestra se aleja de usted cuando se gira en sentido horario.
Definición: Hélice para diestros
La rotación en el sentido de las agujas del reloj aleja una hélice
La punta de una pala de una hélice zurda describe una hélice zurda a medida que se aleja, la punta de una pala de una hélice diestra describe una hélice diestra a medida que se aleja.
Determinar la manejabilidad de los “Compices de Hélice”
¿Cómo podemos determinar la manejabilidad de una molécula de hélice? Determinémoslo usando el ejemplo del anión tris (oxalato) ferrato (III). Fig. 5.4.19.
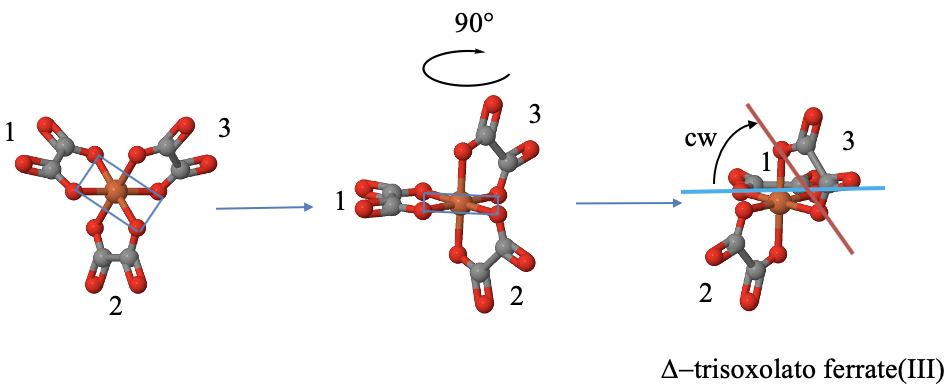
Es una molécula de hélice de tres palas porque tiene tres anillos de cinco miembros entre los tres ligandos de oxolato y el centro de hierro. Cada anillo se considera una cuchilla. Ninguno de los anillos es coplanario y ninguno de ellos es adyacente, lo que significa que los anillos no comparten un átomo donante.
Para determinar la mano, primero podemos rotar la molécula para que uno de los anillos se oriente horizontalmente y apunte hacia atrás. A menos que tengamos un modelo tridimensional, necesitamos hacer esto en nuestra mente. Una vez que esto se logra, podemos trazar una línea horizontal entre los dos átomos donantes de ese anillo. A continuación podemos trazar una línea entre dos átomos donantes de otro anillo. Si es necesario, extendemos la línea para que la línea cruce la línea horizontal. A continuación, determinamos el ángulo más pequeño entre las dos líneas, y giramos la línea no horizontal hasta que se vuelva horizontal. Podemos hacer esto solo en nuestra mente. Si necesitamos girar en sentido contrario a las agujas del reloj, la hélice se considera zurda, la llamamos\(\Lambda\) isómero. Si necesitamos girar en sentido horario, el propulsor es diestro, lo llamamos\(\Delta\) -isómero.
Determinación de la manejabilidad para moléculas de hélice que requieren más de una etiqueta
En algunos casos, los compuestos de coordinación tienen múltiples combinaciones de anillos no adyacentes y no coplanares, y la manejabilidad debe determinarse para cada combinación. Los ejemplos son los complejos de EDTA octaédrico.
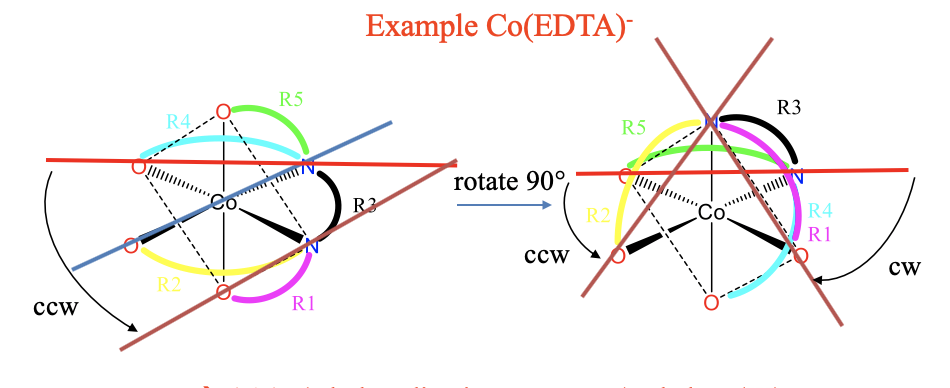
En esos complejos hay en general cinco anillos diferentes que podemos etiquetar de R1 a R5. Se pueden ver los diferentes anillos en diferentes colores (Fig. 5.4.20) Para mayor claridad hemos abreviado los enlazadores entre los átomos donantes por líneas dobladas en diferentes colores. Cada color representa un enlazador diferente que hace un anillo diferente.
Nos damos cuenta de que el anillo R3 es compartido con todos los demás anillos, por lo tanto es adyacente a todos los demás anillos y no necesita ser considerado. R1 es adyacente a R2, y R3, pero no adyacente y no coplanar con R4 y R5. Por lo tanto, debemos considerar las combinaciones R1-R4 y R1-R5. Además, R2 es coplanario con R3 y R4, y adyacente a R3, pero no es coplanar y no adyacente a R5. Por lo tanto, también debemos considerar la combinación R2-R5. R4 y R5 son adyacentes, por lo que no necesitamos considerar esta combinación. Hemos encontrado todas las combinaciones que necesitamos.
Ahora necesitamos rotar el complejo para que un anillo relevante esté orientado horizontalmente y apunte hacia atrás. Podemos por ejemplo elegir el anillo R4. Por suerte, ya está correctamente orientado. A continuación, podemos conectar los átomos donadores del anillo R4 para producir una línea horizontal. Ahora trazar una línea entre los átomos donantes del anillo R1. Vemos que necesitamos rotar la línea horizontal en sentido antihorario para hacerla paralela a esta línea, así la combinación de anillos R1-R4 es una\(\Lambda\) configuración -.
A continuación podemos determinar el manejo de R1-R5 reorientando primero la molécula para que R5 apunte hacia atrás. También podría elegirse R1. Sin embargo, R5 es parte de dos combinaciones de anillos relevantes, por lo que podemos matar dos pájaros de un tiro si elegimos R5. Podemos mover el anillo R5 hacia atrás girando 90° en sentido antihorario alrededor del eje azul que se muestra en la Fig. 5.4.20. En pasa por un átomo de O, el átomo de cobalto, y un átomo de N. Este eje se sitúa perpendicular al cuadrado indicado por líneas punteadas. El cuadrado tiene cuatro átomos donadores en los cuatro vértices, y estos átomos donantes se mueven 90° en sentido antihorario a medida que se lleva a cabo la rotación. La orientación de los anillos sigue el movimiento de los átomos donantes. El átomo donador O del anillo R5 se mueve de manera que R5 es ahora horizontal, y apunta hacia atrás. A continuación podemos interconectar los átomos donantes de R5, y los átomos donantes de R1 por líneas. Podemos ver que la línea horizontal debe girarse en el sentido de las agujas del reloj para que quede paralela a la otra. Por lo tanto, la configuración R1-R5 es una\(\Delta\) configuración.
Para la determinación de la combinación R2-R5 el complejo no necesita ser reorientado de nuevo. Podemos trazar directamente una línea a través de los átomos donantes de R2, y determinar la dirección de rotación. Esta vez necesitamos girar de nuevo en sentido contrario a las agujas del reloj, lo que significa que la combinación R2-R5 está en\(\Lambda\) -configuración.
En general, tenemos un λΔλ- (etilendiamina tetracetato) cobaltato (III). Tenga en cuenta que el orden de designación es arbitrario, podríamos haber nombrado a la molécula un complejo λλδ-o un complejo Δλλ-también.
Ejercicio
Practicemos esto con un ejemplo más.
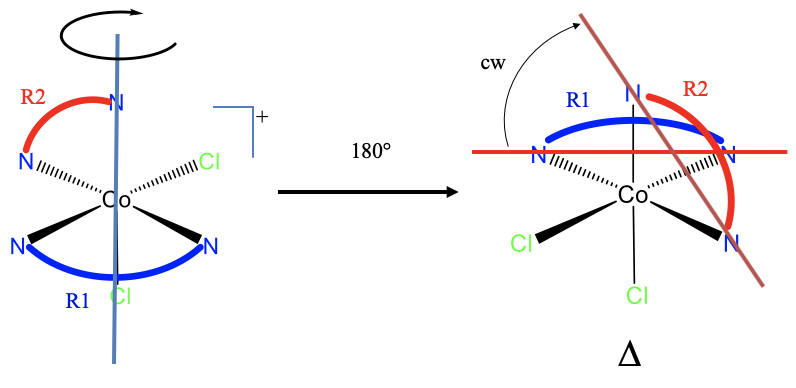
¿Cuál es la mano del complejo que se muestra? En primer lugar: ¿Cumple con los criterios para un complejo de hélices? La respuesta es sí. Hay dos anillos, R1 y R2, y ambos no son coplanarios y no adyacentes.
Para determinar la mano necesitamos primero mover la molécula para que un anillo esté orientado horizontalmente y apunte hacia atrás. Podríamos elegir cualquiera de ellos, pero parece más fácil rotar el anillo R1 que apunta hacia el frente y está orientado horizontalmente 180° alrededor de un eje que está definido por un N y sobre un átomo de Cl (mostrado en azul en la Fig. 5.4.21)), y está orientado verticalmente. Esta rotación mueve 180° uno de los átomos donantes del otro anillo, lo que define la nueva orientación del anillo. Ahora podemos trazar una línea horizontal a través del átomo donante del anillo 1, y una línea a través de los átomos donantes del anillo R2. Podemos ver que debemos girar en sentido horario, y el complejo de hélices es diestro.
Conformaciones de anillo
Además del isomerismo, también el conformerismo influye en la estructura de un compuesto de coordinación. Puede haber dos o más confórmeros posibles para un isómero particular. Como ejemplo, consideremos un anillo entre un ión metálico y un ligando etilendiamina (Fig. 5.4.22).
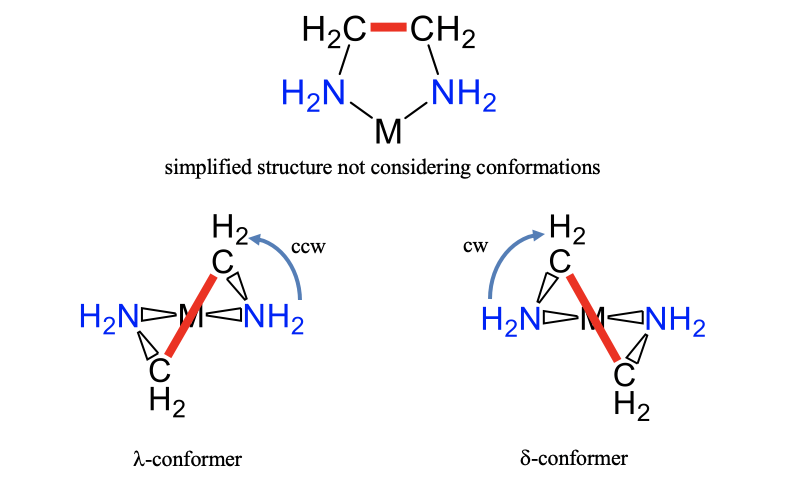
En contraste con las representaciones simplificadas de uso frecuente, no es plana, debido a la sp 3 -hibridación de los átomos de carbono y nitrógeno. Hay dos conformaciones diferentes posibles que difieren en la orientación del enlace C-C dentro del anillo. Se muestran arriba (Fig. 5.4.22). En la conformación que se muestra a la izquierda debemos rotar una línea horizontal de pensamiento que atraviesa los dos átomos donadores de nitrógeno en sentido antihorario para que quede paralela al enlace C-C. Para el otro conformador, necesitamos rotar la línea horizontal del pensamiento en el sentido de las agujas del reloj. Llamamos al primer conformador el\(\lambda\) -conformador, y al segundo el\(\delta\) -conformador. En este caso utilizamos letras minúsculas para indicar conformerismo y no isomería.


