10.1: Antecedentes históricos e introducción a los metalocenos
- Page ID
- 70069
Química Organometálica
En este capítulo obtendrá una introducción en un subcampo de la química de coordinación: Química organometálica. ¿Cómo se define un complejo orgamometálico?
Definición: Complejo organometálico
Un complejo con interacciones de enlace entre uno o más átomos de carbono de un grupo orgánico o molécula y al menos un átomo metálico se denomina complejo organometálico.
Se define como un complejo con interacciones de enlace entre uno o más átomos de carbono de un grupo orgánico o molécula y al menos un átomo metálico. Es importante entender que solo la presencia de un ligando orgánico aún no es suficiente para definir un compuesto organometálico. Debe haber interacciones entre un átomo de carbono y un átomo de metal. Si un ligando orgánico está presente pero ningún átomo donante es un átomo de carbono, entonces llamamos a este complejo un complejo metal-orgánico.

Figura\(\PageIndex{1}\): Ejemplo de complejos organometálicos vs metal-orgánicos
Practicemos esto con un ejemplo: cuáles de las siguientes moléculas son metal-orgánicas y organometálicas respectivamente: tetrametilestaño y tetrametoxi estaño (Figura\(\PageIndex{1}\)). El primero es organometálico mientras que el segundo es metal-orgánico. ¿Por qué? Esto se debe a que en el tetrametilestaño hay enlaces Sn-C, mientras que en el tetrametoxi estaño hay enlaces Sn-O.
Importancia Industrial de los Compuestos Organometálicos
Los compuestos organometálicos son una clase de compuestos industrialmente muy importante. Por ejemplo, los compuestos alquílicos de aluminio y estaño se producen en cantidades del orden de decenas de mil toneladas por año. Sin embargo, aún más importante es el uso de compuestos organometálicos como catalizadores para producir otros compuestos. Esto va desde polímeros básicos como polipropileno y polietileno hasta moléculas orgánicas simples como acetaldehído y ácido acético. Estos compuestos se producen a una escala del orden de millones de toneladas al año.
Historia de la Química Organometálica
Tomemos un enfoque histórico de la química organometálica y veamos cómo ha evolucionado el campo. El primer compuesto organometálico fue óxido de kakodilo, un compuesto organo-arsénico.
Fue producido accidentalmente por el químico francés Louis Cadet en 1760 cuando trabajaba en tintas. Calentó óxido de arsénico y acetato de potasio y obtuvo un líquido oleoso de color marrón rojizo, conocido como líquido de humo de Cadet.
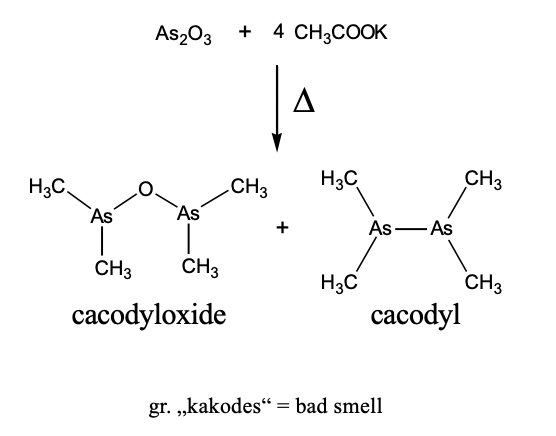
Consiste principalmente en cacodilo y óxido de cacodilo (Figura\(\PageIndex{2}\)). En el cacodilo, hay un enlace As-As y dos grupos metilo unidos a cada átomo As. En el óxido de cacodilo, hay un átomo de O entre los dos átomos As, y cada As está unido a dos grupos metilo. Los nombres de estos compuestos provienen de la palabra griega “kakodes” =mal olor. En efecto, tienen un olor muy intenso, parecido al ajillo. La reacción puede ser utilizada para identificar arsénico en muestras. Por ejemplo, si sospechabas que tu comida estaba envenenada con arsénico, podrías calentar una muestra junto con acetato de potasio. Si evolucionara un mal olor a ajo, entonces esto indicaría que hay arsénico en tu muestra.

Otro hito importante en la química de coordinación fue el descubrimiento de la sal de Zeise por el químico danés William Zeise en 1827 (Figura\(\PageIndex{3}\)). La sal de Zeise fue el primer complejo de olefina en el que una olefina se unió de lado a un metal usando sus electrones π para la unión σ. Zeise observó que cuando el hexacloroplatinato de sodio (2-) se calentó en etanol, se pudo aislar un compuesto con la composición Na [PtcL 3 (C 2 H 4)]. La composición química del compuesto sugirió que había un fragmento orgánico C 2 H 4 unido al platino, pero no estaba claro cómo.
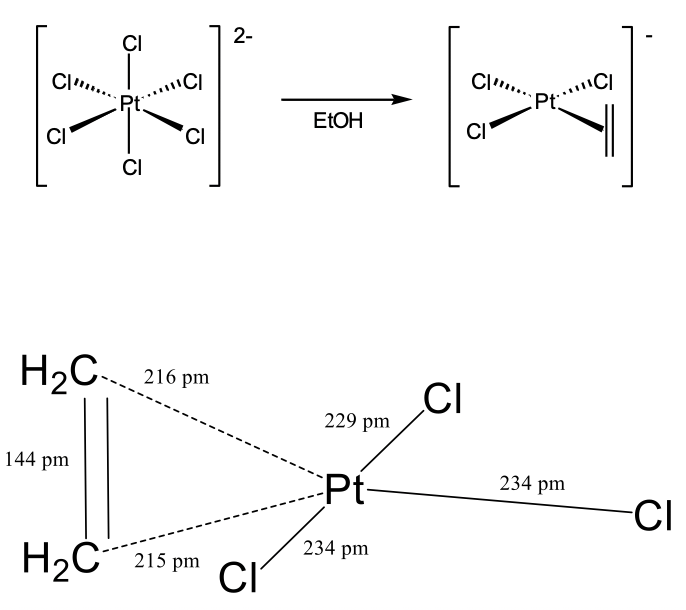
Esta pregunta solo fue respondida más de 100 años después en 1969 con el análisis de la estructura cristalina de la sal de Zeise. La estructura cristalina reveló que una molécula de etileno estaba unida de lado al platino (Figura\(\PageIndex{4}\)). Los dos átomos de carbono tenían aproximadamente la misma distancia al Pt argumentando que estaban igualmente fuertemente involucrados en la unión con Pt. El primer C tuvo una distancia de 216pm mientras que el segundo carbono tuvo una distancia de 215pm. La molécula de etileno se orientó perpendicular al plano formado por los tres ligandos de cloro y el átomo de platino. Los ángulos de enlace Cl-Pt-Cl fueron cercanos a 90°. En general, la estructura podría describirse como una estructura derivada de una estructura plana cuadrada con el etileno como el cuarto ligando que se mantendría perpendicular al plano para minimizar la repulsión estérica con los ligandos cloro.
Una pregunta importante fue cómo describir la unión en el compuesto. Se destacó que la longitud del enlace C-C en la sal de Zeise fue significativamente mayor (144pm) que en una molécula de etileno libre (134pm). Con base en el concepto bond-strength bond-length, esto argumentó que el enlace era más débil que un doble enlace C=C regular, y que el orden de enlace era menor que 2. ¿Qué podría explicar este orden de enlace inferior y la coordinación lateral del etileno en la sal de Zeise?
Vinculación en la Sal de Zeise
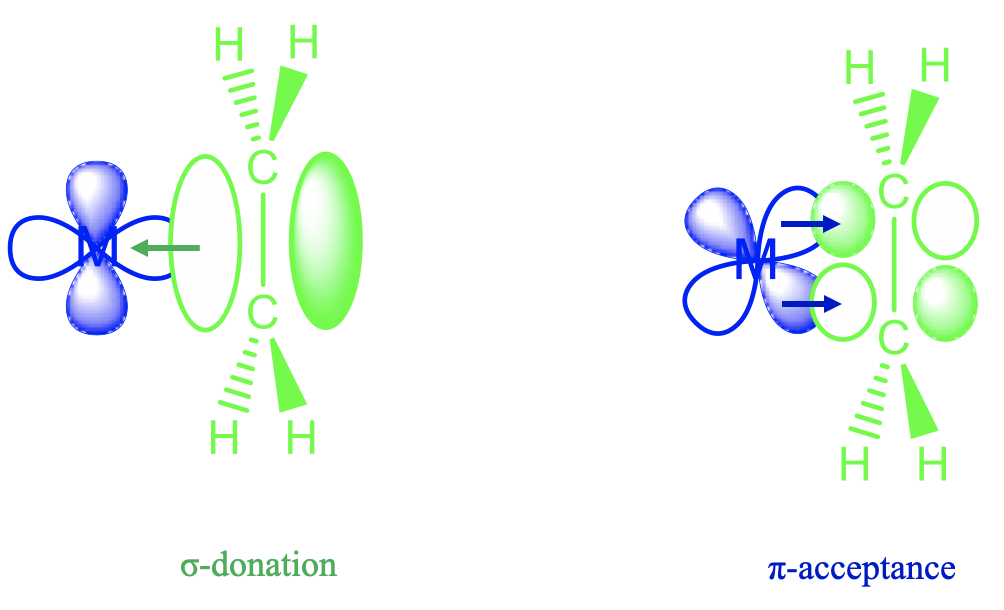
La respuesta es que la molécula de etileno utiliza sus electrones π para el enlace σ-orbital con un metal d-orbital (Figura\(\PageIndex{5}\)). Se puede ver arriba que el lóbulo de un orbital d x 2 -y 2 tiene la orientación correcta para solaparse con los orbitales π-enlazantes del ligando de etileno en una forma σ-. A través de esta interacción, la densidad de electrones se dona del ligando de enlace π-orbital al metal-d-orbital. Esto da como resultado una menor densidad de electrones para la unión p dentro del ligando, y así el orden de enlace disminuye. Además, hay otro efecto que baja el orden de fianza. Un d-orbital metálico puede interactuar con los orbitales π*-en forma π-. En este proceso, la densidad de electrones puede ser donada desde el metal d-orbital a los orbitales π-vacíos del ligando. El aumento de la densidad electrónica en los orbitales π-disminuye aún más el orden de los enlaces.
En 1890, se alcanzó otro hito en la química organometálica con la síntesis del primer complejo carbonílico, el tetracarbonilo de níquel. El tetracarbonilo de níquel es un líquido incoloro que hierve a 43°C.

El compuesto fue preparado por el químico alemán Ludwig Mond (Figura\(\PageIndex{6}\)). El tetracarbonilo de níquel se forma espontáneamente a partir de níquel metal y monóxido de carbono a temperatura ambiente.

La reacción es la base del proceso Mond que se utiliza hasta la fecha para purificar el níquel (Figura\(\PageIndex{7}\)). El gas monóxido de carbono puede ser transmitido sobre Ni metálico impuro a temperaturas de 50-60°C para formar Ni (CO) 4 en forma gaseosa. Las impurezas se dejan atrás en forma sólida.

Luego, el tetracarbonilo de níquel se descompone térmicamente a ca. 220° para formar níquel y monóxido de carbono. El proceso se puede variar para producir níquel en forma de polvo, como esferas (Figura\(\PageIndex{8}\)) y como recubrimientos. El proceso de Mond se utiliza hasta la fecha a pesar de la muy alta toxicidad del tetracarbonilo de níquel.

En 1900 se descubrieron los primeros reactivos de Grignard. Victor Grignard (Figura\(\PageIndex{9}\)) fue un entusiasta joven químico francés que descubrió cómo hacer haluros de organomagnesio (RMGx) mientras trabajaba para su Ph.D.
Su supervisor, Sabatier, llevaba algún tiempo probando esta química, pero Víctor fue el genio que resolvió el problema. Los haluros de organomagnesio se forman a partir de magnesio y haluros orgánicos en éteres. Este descubrimiento en 1900 cambió el curso de la química orgánica y ganó Grignard y Sabatier el Premio Nobel en 1912.

En 1917, los primeros alquilos de litio fueron preparados por Wilhelm Schlenk (Figura\(\PageIndex{11}\)). Al igual que los reactivos de Grignard, los alquilos de litio son reactivos muy valiosos en la química orgánica sintética. Los alquilos de litio son compuestos muy sensibles al aire, y algunos incluso se autoinflaman en el aire, por ejemplo, terc-butil litio. Por lo tanto, necesitan ser manejados cuidadosamente bajo gas inerte.
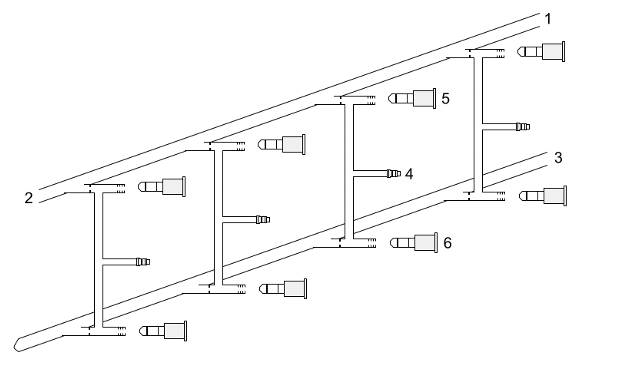
Al respecto, Wilhelm Schlenk realizó una invención importante: Las líneas Schlenk (Figura\(\PageIndex{12}\)). Las líneas Schlenk permiten evacuar los matraces de reacción y rellenarlos con un gas inerte. Una línea Schlenk tiene un colector doble con varios puertos. Un colector está conectado a una fuente de gas inerte purificado, mientras que el otro está conectado a una bomba de vacío. La línea de gas inercia se ventila a través de un burbujeador de aceite, mientras que los vapores de disolvente y los productos de reacción gaseosos se previenen de contaminar la bomba de vacío mediante una trampa fría de nitrógeno líquido o hielo seco/acetona. Las llaves de paso especiales o grifos de teflón permiten seleccionar el vacío o el gas inerte sin necesidad de colocar la muestra en una línea separada.
Los descubrimientos discutidos fueron hitos importantes en el desarrollo de la química organometálica, pero el campo se expandió solo rápidamente con el descubrimiento del primer metaloceno: El ferroceno. Como muchas veces en la ciencia, el ferroceno fue descubierto a través de un accidente.
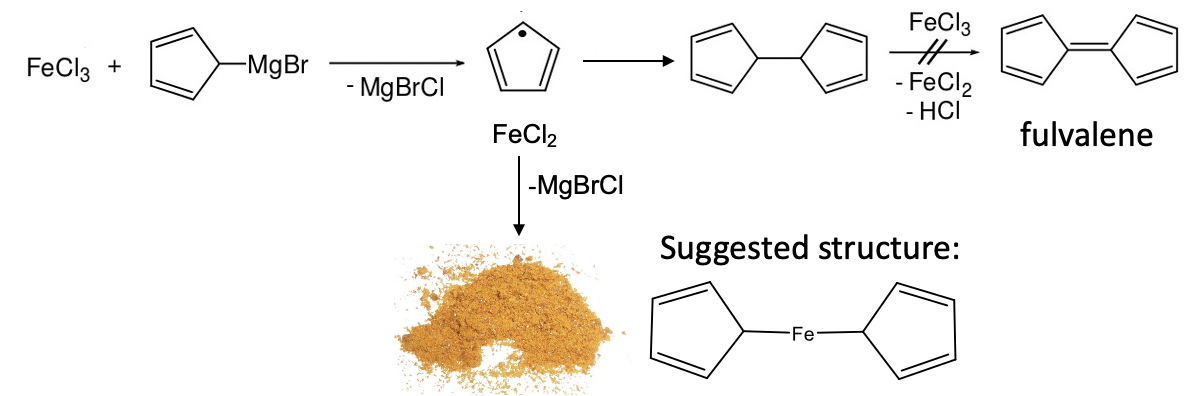
En 1951 Peter Pauson y Thomas Kealy intentaron sintetizar el compuesto orgánico fulvaleno a través del acoplamiento oxidativo de cloruro de ciclopentadienilmagnesio con cloruro de hierro (III). Sin embargo, en lugar de obtener fulvaleno observaron la formación de hidrofulvaleno junto con un polvo de naranja con “notable estabilidad”. El análisis del polvo mostró que el compuesto químico contenía dos anillos de ciclopentadienilo y un átomo de hierro. De acuerdo con los conocimientos sobre unión en compuestos organometálicos que se conocían en su momento Kealy y Pauson sugirieron una estructura para la molécula en la que dos grupos ciclopentadienilo estaban unidos a un solo átomo de Fe a través de dos enlaces Fe-C (Figura\(\PageIndex{13}\)).
Sin embargo, la notable estabilidad del compuesto estaba en contradicción con esta estructura. La estructura sería un complejo de 10 electrones que estaría altamente insaturado de manera coordinada. Esto sería inconsistente con la estabilidad observada. Podemos volver a practicar brevemente nuestras habilidades de conteo de electrones para demostrar que solo hay 10 electrones (Figura\(\PageIndex{14}\)).
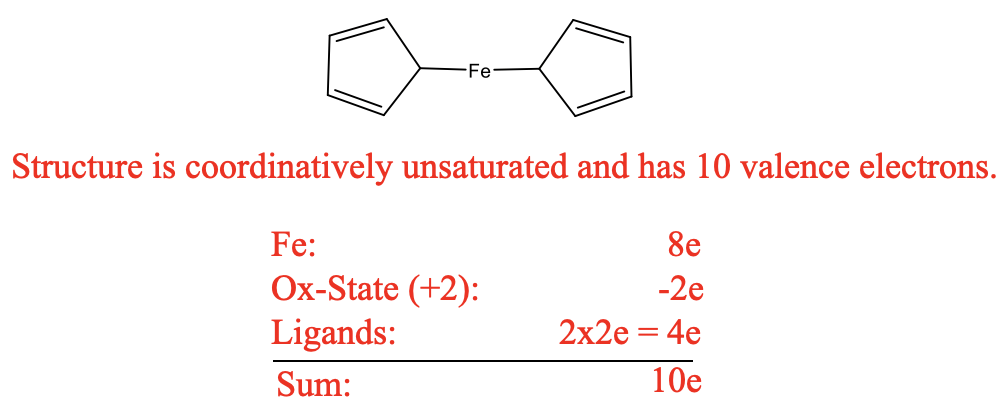
Por ejemplo podemos usar el método del estado de oxidación para el conteo de electrones. El Fe en estado neutro tiene ocho electrones de valencia. Se escindirían los enlaces heterolépticamente lo que crearía aniones ciclopentadienilo con una carga 1-. Esto significaría que el Fe está en el estado de oxidación +2, y así restaríamos dos electrones. Los aniones de ciclopentadienilo aportarían dos electrones cada uno dando diez electrones en general. En contraste con las expectativas, el compuesto fue estable en el aire, y podría ser sublimado sin descomposición. Además, los dobles enlaces en los anillos de ciclopentadienilo resistieron la hidrogenación. Además, la estructura fue inconsistente con las observaciones espectroscópicas. Solo se observó una vibración de estiramiento C-H en el IR y solo se observó una señal en la RMN de 1H. La estructura de Kealy y Pauson habría sido consistente con tres vibraciones de estiramiento C-H y tres resonancias de RMN.

Por estas razones, pronto se cuestionó la estructura de Kealy y Pausons. Ernst Otto Fischer de la Universidad de Múnich y Sir Geoffrey Wilkinson de la Universidad de Harvard (Figura\(\PageIndex{15}\)) sugirieron una estructura alternativa muy diferente de todas las estructuras organometálicas conocidas. La unión en esta estructura fue completamente diferente de todos los conceptos de unión considerados hasta ahora para los organometálicos.
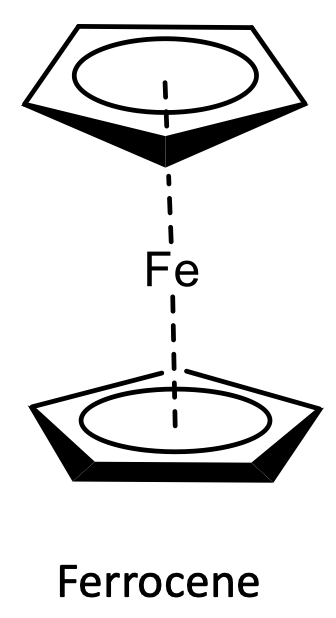
¿Qué estructura propusieron? Propusieron una estructura sándwich en la que los dos aniones aromáticos de ciclopentadienilo emparedarían un ion Fe 2 +. ¿Cuál sería el vínculo en esta estructura? El anión cilopentadienilo donaría sus seis electrones π a los orbitales de valencia del metal. Así, los cinco átomos de carbono estarían igualmente involucrados en el enlace, el ligando actuaría como un ligando 5. Debido a la donación de electrones π en la unidad de cicopentadieno, la estructura se denominó “ferroceno”. La estructura del ferroceno explicaría la estabilidad y baja reactividad del compuesto.
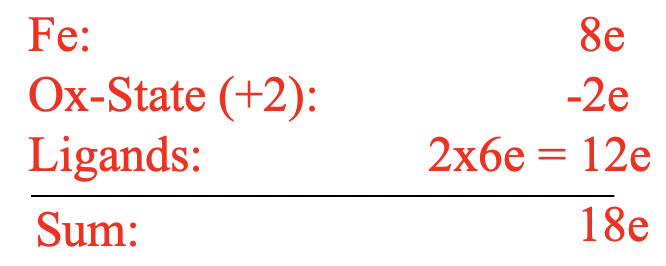
El conteo de electrones da un complejo de 18 electrones. Verifiquemos esto usando el método del estado de oxidación. El Fe aportaría ocho electrones en estado neutro. Los ligandos serían considerados como aniones de ciclopendienilo con una carga 1. Esto daría un estado de oxidación de +2 para el Fe reduciendo el número de electrones de ocho a seis. Los dos ligandos aportarían seis electrones cada uno dando doce electrones. 12+6=18. De ahí que la estructura cumpla con la regla de los 18 electrones. La estructura también es consistente con la observación espectroscópica de una resonancia de RMN y una vibración de estiramiento C-H. Todos estos fueron excelentes argumentos para apoyar la estructura del sándwich de ferroceno, sin embargo no fueron una prueba absoluta. La prueba finalmente llegó con la determinación de la estructura cristalina de rayos X que confirmó inequívocamente la estructura sándwich.
Vinculación en teoría de ferroceno y MO
¿La estabilidad de la estructura del ferroceno también puede ser explicada por la teoría orbital molecular? ¡Vamos a comprobarlo! Primero, tenemos que decidir sobre el grupo de puntos. Haremos la simplificación de que los dos anillos de ciclopentadienilo C p están en formación eclipsada, y luego el grupo puntual es D 5h. En realidad, los anillos están en confirmación escalonada y el grupo de puntos es D 5d, pero la diferencia de energía es mínima, y hay una barrera de activación muy pequeña entre los dos confórmeros.
\ begin {array} {|c|rrrrrrrrr|cc|}
\ hline\ bf {D_ {5h}} & E & 2C_5 & 2C_5 & 2C_5^2 & 5C_2 &\ sigma _h & 2S_5 & 2S_5^2 & 5\ sigma_h & h=20 &
\\ hline A_ {1} 'y 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1 & & & x^2+y^2,\; z^2\\ A_ {2} '& 1 & 1 & 1 & -1 & 1 & 1 & 1 & -1 & r_z &\\
E_ {1}' & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & (x,\; y) &\\
E_ {2} 'y 2 & 2cos (144 ^ { \ circ}) & 2cos (72 ^ {\ circ}) & 0 & 2 & 2cos (144 ^ {\ circ}) & 2cos (72 ^ {\ circ}) & 0 & & (x^2-y^2,\; xy)\\
A_ {1}” & 1 & 1 & 1 & -1 & -1 & -1 & & -1 & &\\
A_ {2}” & 1 & 1 & 1 & -1 & -1 & -1 & -1 & 1 & z &\\
E_ {1}” & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & -2 & -2cos (72 ^ {\ circ}) & -2cos (144 ^ {\ circ}) & 0 & (R_x,\; R_y) & (xz,\; yz)\\
E_ {2}” & 2 & 2cos (144 ^ {\ circ}) & 2cos (72 ^ {\ circ}) & amp; 0 & -2 & -2cos (144 ^ {\ circ}) & -2cos (72 ^ {\ circ}) & 0 & &\\
\ hline\ end {array}
Podemos definir el eje z de pie perpendicular a los anillos Cp, y el plano xy para ser coplanario con los anillos Cp.
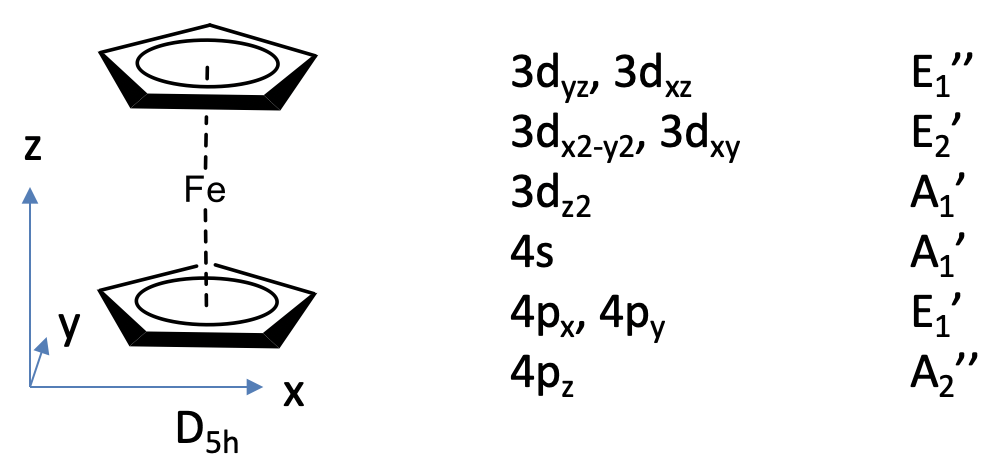
Los orbitales Fe 3d, 4s y 4p serán nuestros orbitales fronterizos y podremos leer sus tipos de simetría en la tabla de caracteres de D 5h. El 3d xz y 3d yz tienen E 1” simetría, el 3d x 2 -y 2 y el 3d xy tienen E 2 'simetría, el 3d z 2 tiene A 1' simetría, el 4s tiene simetría A 1 ', y los orbitales 4p x y 4p y tienen simetría E 1', y el 4p z tiene simetría A 2”.
A continuación, necesitamos determinar los orbitales del grupo de ligandos. Sabemos que los orbitales moleculares del ligando π son los que donan los electrones a los orbitales metálicos, así tenemos que tener una mirada más cercana a estos orbitales. Los π-MOS del ligando están hechos de los cinco orbitales 2p z de los átomos de carbono que se encuentran perpendiculares al anillo. Esto significa que hay 5 MO a considerar.
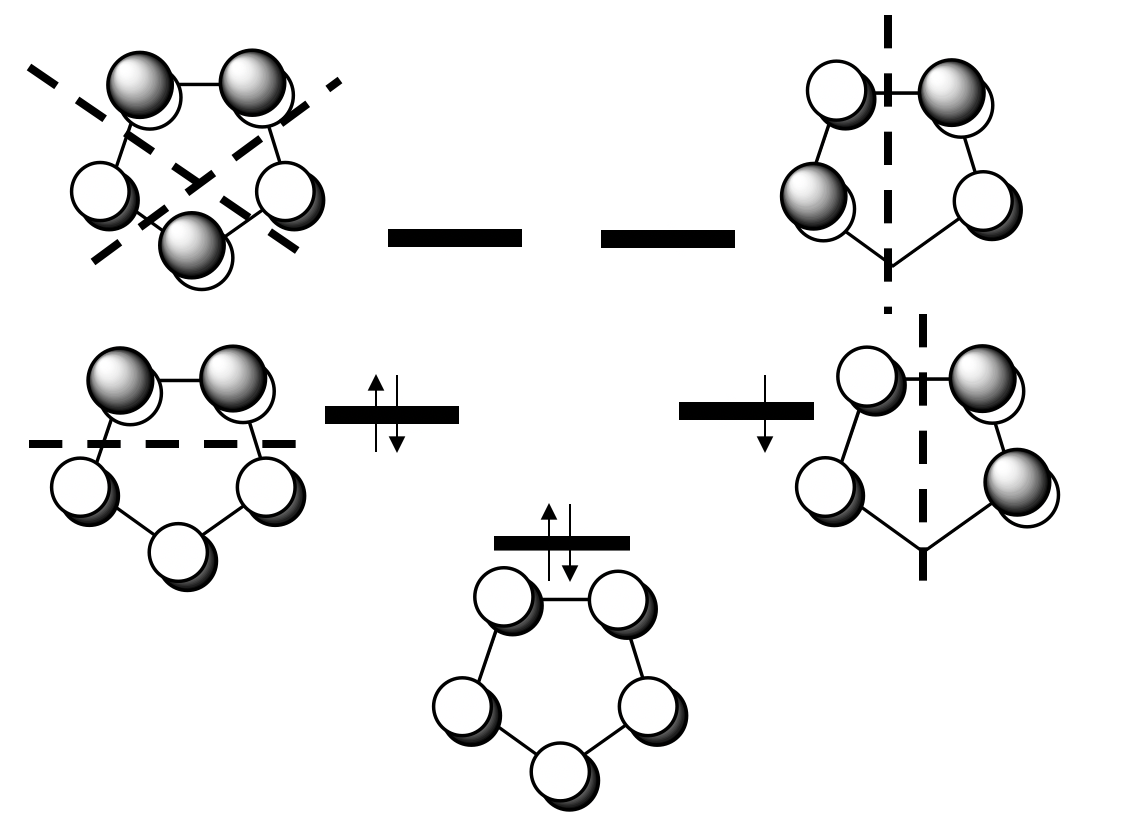
Se pueden ver los cinco MOs y su energía relativa arriba. Uno está fuertemente ligado y no tiene nodo. Entonces, hay dos de doble generación débilmente enlazados que tienen un nodo, y finalmente hay dos anti-bonding que tienen dos nodos. Debido a que el anión ciclopentadienilo tiene seis electrones π, el MO de enlace y los dos MO de enlace débil están llenos, los MO antiunión están vacíos.
Debido a que tenemos dos aniones Cp - a considerar tenemos en general 10 MO para combinar. Por lo tanto, esperaríamos diez orbitales de grupos de ligandos (LGO). Podemos determinar su tipo de simetría determinando las representaciones reducibles e irreducibles. A continuación se muestran los resultados.
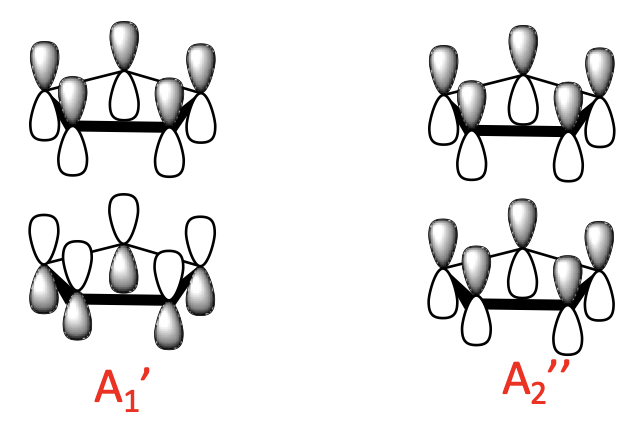
Generalmente podemos dividir las LGO en tres grupos con un número diferente de nodos. Hay dos LGO de 0 nodos con simetría A 1 'y A 2”. Se elaboran a partir de los MO de 0 nodos del ligando. Hay una unión y una combinación anti-adhesión posible. En la combinación de unión, los MOs del ligando de 0 nodos tienen los lóbulos con el mismo signo algebraico apuntando uno hacia el otro. La combinación anti-unión tiene los lóbulos con signo algebraico opuesto apuntando uno hacia el otro.
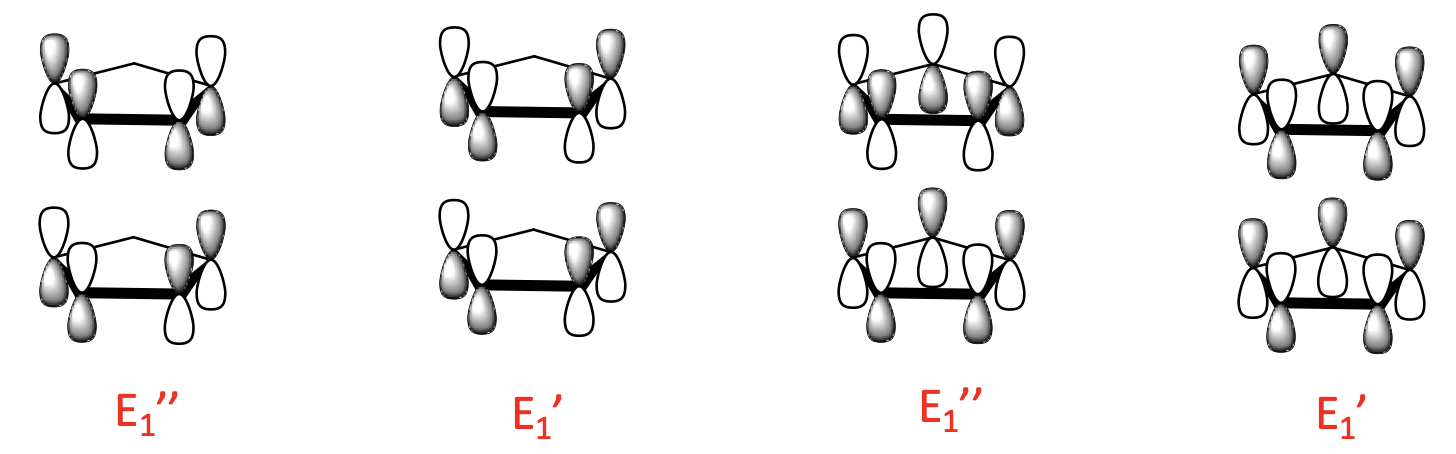
Hay cuatro LGO de 1 nodo con simetría E 1 'y E 1”. Se construyen a partir de los dos MO de ligando de 1 nodo. Al igual que para los orbitales de 0 nodos, existe una combinación de unión y anti-unión posible.
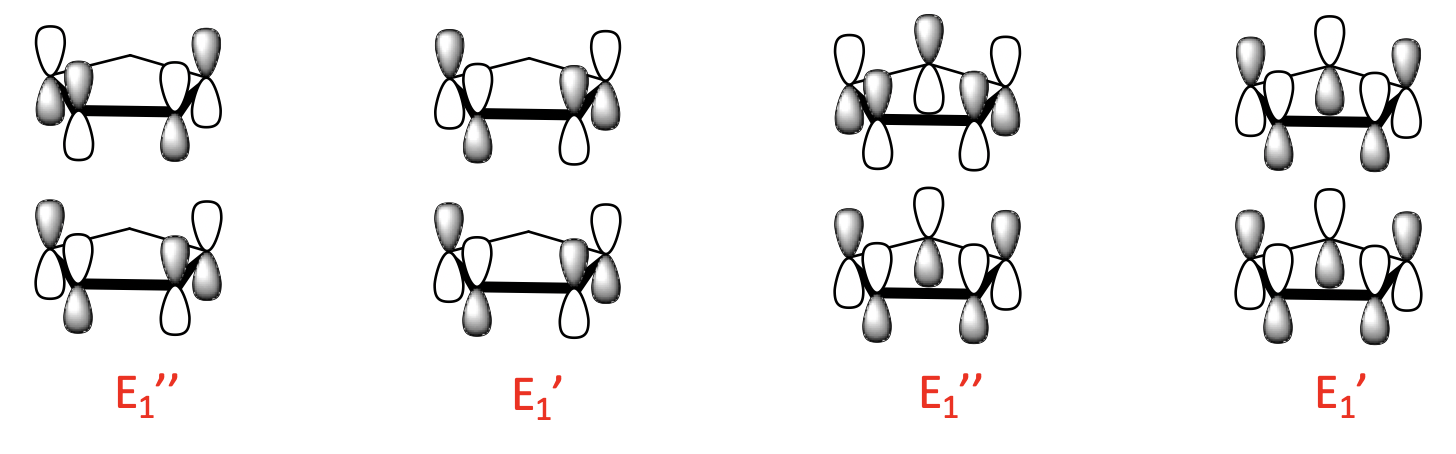
Finalmente, hay cuatro LGO de 2 nodos con simetría E 2 'y E 2”. Están hechos del ligando de 2 nodos MoS y también hay una unión y una combinación anti-unión posible.
El diagrama orbital molecular del ferroceno
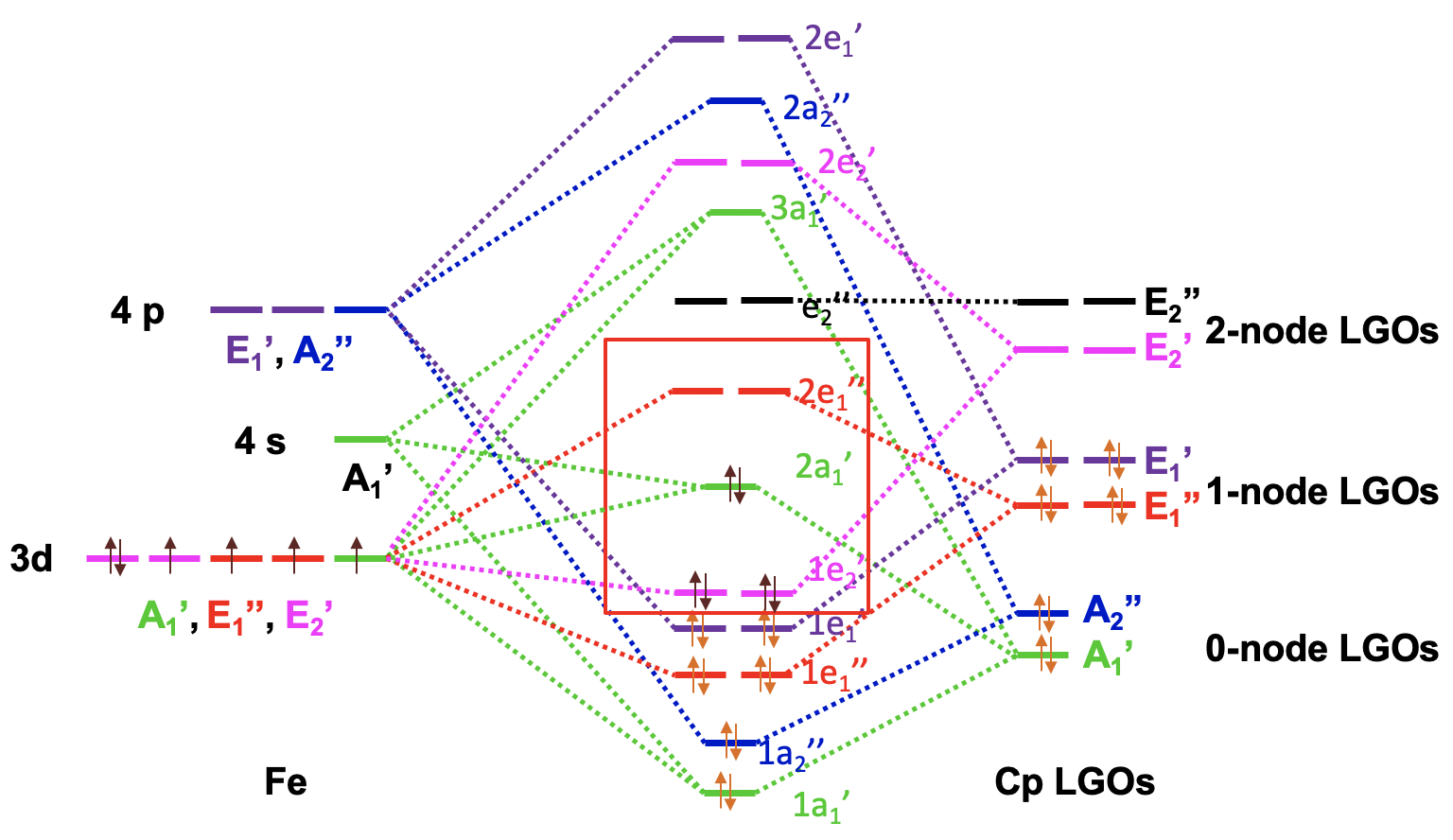
Ahora tenemos toda la información para dibujar el diagrama orbital molecular del ferroceno. Como de costumbre trazamos los orbitales de frontera metálica a la izquierda y etiquetamos su simetría. Trazamos los Cp LGO a la derecha y también etiquetamos la simetría. Podemos ordenar los LGO de acuerdo con la energía con los LGO de 0 nodos que tienen la energía más baja y los LGO de 2 nodos que tienen la energía más alta. Entonces, podemos comenzar a combinar orbitales del mismo tipo de simetría para formar MO. Hay dos AO metálicos del tipo A 1 'y un LGO A 1' que dan tres MO de este tipo de simetría, uno de unión, uno aproximadamente no adhesivo y el tercero anti-adhesión. Podemos conectar AOs, LGO y MO con líneas punteadas. A continuación, podemos combinar el AO A 2” y el LGO A 2” para formar un MO de unión y un MO antiadhesión. Nuevamente conectamos los OA, los OGL y los MO con líneas punteadas. Entonces, podemos producir dos MoS de unión e 1” y dos anti-unión e 1” MO a partir de los AO metálicos E 1” y los IgO E 1” y conectar los orbitales con líneas punteadas. Hay dos E 1 'LGO y dos E 1' AO que se pueden combinar en dos 1e 1 'de unión y dos 2e 1' MO antiadhesión y nuevamente conectamos los orbitales con líneas punteadas. Los dos E 2 'LGO se pueden combinar con los dos orbitales E 2' d para formar un par de orbitales moleculares de enlace 1e 2 'y anti-unión 2e 2'. Por último, notamos que los LGO E 2” no encuentran pareja, y tenemos que escribirlos como no vinculantes con la misma energía en el diagrama MO.
Ahora necesitamos llenar los electrones en los orbitales. Los ligandos tienen doce electrones en total. Se pueden llenar en los seis orbitales de la energía más baja. Esto llena los orbitales 1a 1 ', 1a 2”, 1e 1”, y 1e 1'. Observamos que todos los MO están enlazando lo que apoya la estabilidad de la molécula. Aún tenemos que considerar los orbitales d metálicos. Tenemos un ion Fe 2 + y por lo tanto seis electrones d metálicos. Entrarían en el orbital 1e 2 'que está uniendo y el orbital 2a 1' que se une débilmente. El 2a 1 es el HOMO, y el siguiente superior 2e 1” es el LUMO. Podemos ver que podemos llenar todos los electrones metálicos en MO de unión. El LUMO es un orbital antiunión y, por lo tanto, en general, todos los MO de unión están llenos, y no es necesario llenar orbitales sin unión y antiunión. Esta es la situación ideal para una molécula estable. También podemos ver que el diagrama MO explica la regla de 18 electrones. Todos los 18 electrones están en MO de unión.
Podemos considerar los d-orbitales 1e 2 ', 2a 1' y 2e 1” metálicos en el campo ligando producido por los ligandos CP ya que estos 5 orbitales pueden contener el número máximo posible de 10 electrones d, tener energía similar a la de los orbitales d, y tener contribuciones de ellos.
Metalocenos con otros ligandos p cíclicos
¿Es posible hacer metalocenos con otros anillos conjugados con π pero el anión cilopentadienilo?
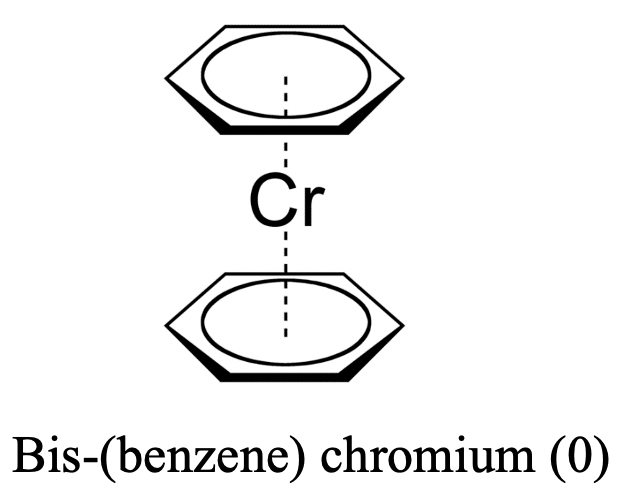
La respuesta es sí, por ejemplo se sabe que el benceno actúa como ligando bis- (benceno) cromo (0). En este caso el ligando actúa como un ligando 6 porque los seis átomos de carbono están involucrados en el enlace. ¿Por qué el cromo da un complejo estable de metaloceno con benceno? Esto lo podemos explicar de nuevo con la regla de los 18 electrones. En el bis- (benceno) cromo (0), el cromo se encuentra en el estado de oxidación 0 debido a que el ligando de benceno no tiene carga. Así, el cromo aporta seis electrones. Al sumar los 12 electrones π de los dos ligandos de benceno se obtienen 18 electrones.
Otros ligandos p cíclicos
También el ciclobutadieno puede actuar como un ligando p cíclico en complejos. El ciclobutadieno es diferente del anión ciclopentadienilo y el ligando de benceno de dos maneras. En primer lugar, tiene mucha más cepa de anillo que las dos anteriores, y en segundo lugar no es un ligando aromático, sino un ligando antiaromático. Recuerde, tenemos un anillo aromático cuando hay 4n+2 π-electrones, donde n es un número inter. Esto significa que los anillos con dos (n=0), seis (n=1) y diez (n=2) π-electrones son aromáticos. Los anillos antiaromáticos son aquellos que tienen 4n electrones, como cuatro (n=1), ocho (n=2) y así sucesivamente. El ciclobutadieno tiene cuatro electrones, y por lo tanto es antiaromático. Los anillos antiaromáticos son menos estables que los aromáticos porque no todos los electrones π están en orbitales moleculares enlazados. Ilustremos esto construyendo el diagrama MO para el sistema π de la molécula de ciclobutadieno (Figura\(\PageIndex{25}\))
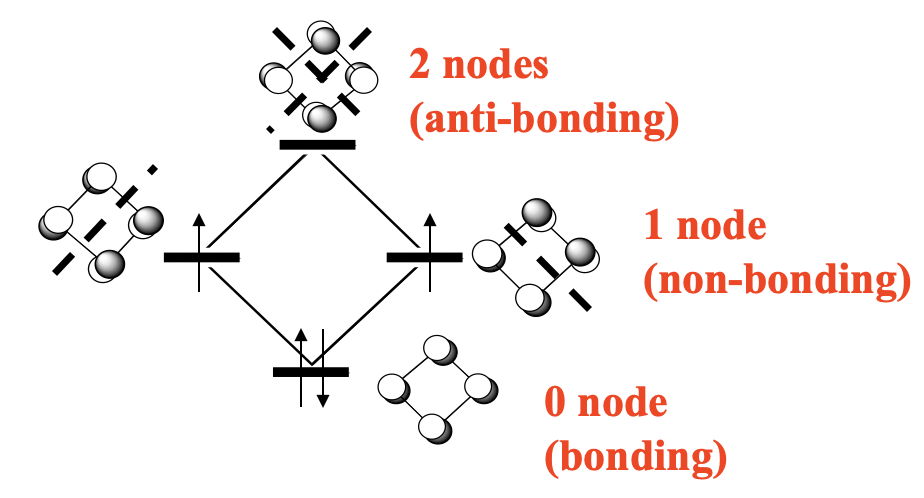
El sistema π está compuesto por cuatro átomos de carbono que aportan un orbital 2p z medio lleno cada uno (si definimos el plano de la molécula como el plano xy). Eso hace cuatro orbitales p con cuatro electrones que dan cuatro orbitales moleculares. Hay un MO de unión sin nodo, dos dos no vinculantes doblemente degenerados con un nodo y uno anti-vinculación con dos nodos (Figura\(\PageIndex{25}\)). Hay cuatro electrones. Podemos llenar dos electrones en el MO de unión, pero los otros dos deben entrar en los dos no enlazantes bajo obediencia al gobierno de Hund.
Distorsión Jahn-Teller en ciclobutadieno
Uno puede pensar que el ciclobutadieno es una molécula plana cuadrada debido a la deslocalización completa de los electrones π, pero en realidad ese no es el caso. Hay dos dobles enlaces más cortos y dos enlaces simples más largos, y la forma de las moléculas es un rectángulo. Esto significa que los dos dobles enlaces están localizados. Podemos ver este efecto como una distorsión de Jahn-Teller.
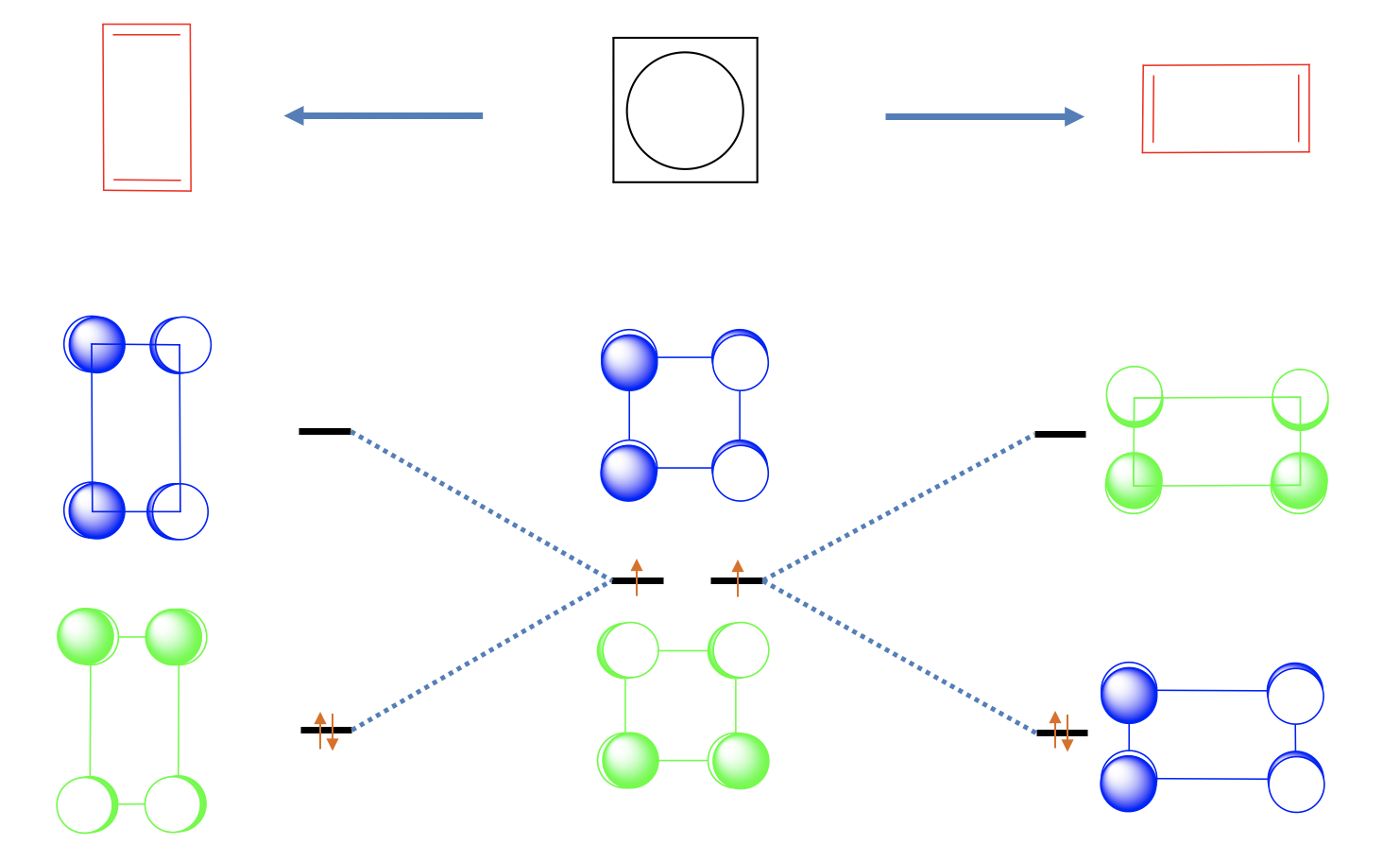
La distorsión del cuadrado para formar un rectángulo es energéticamente favorable porque disminuye la energía de los dos electrones no enlazantes. ¿Por qué? Veamos primero el orbital sin unión 1 y alarguemos en la dirección x, y apretemos en dirección y (Figura\(\PageIndex{26}\)). Podemos ver que separamos más los orbitales p con interacciones de unión, y acercamos a aquellos con interacciones antienlace. Esto significa que la energía de este orbital sube y el orbital se vuelve antienlace. Hagamos lo mismo con orbitales no vinculantes 2. Vemos que sucede lo contrario. Las interacciones de unión se potencian y las interacciones anti-unión se debilitan. Por lo tanto, este orbital se convierte en unión y la energía baja. Ahora podemos llenar los dos electrones en el MO de unión. Vemos que hemos bajado la energía de los electrones a través de la distorsión.
También podríamos haber exprimido en dirección x y alargado en dirección y. En este caso orbital 1 se habría convertido en unión y orbital 2 antiadhesión. Sin embargo, esta distorsión es simetría-equivalente a la anterior, y no produce una nueva molécula. Ambas moléculas pueden superponerse mediante una simple rotación de 90°.
Ciclobutadieno como ligando 4
El ciclobutadieno (Cb) en su forma libre no es estable debido a la alta cepa del anillo y la antiaromaticidad, pero los complejos con ciclobutadieno como ligando son estables. Se esperaría que 18 complejos de electrones sean los más estables.
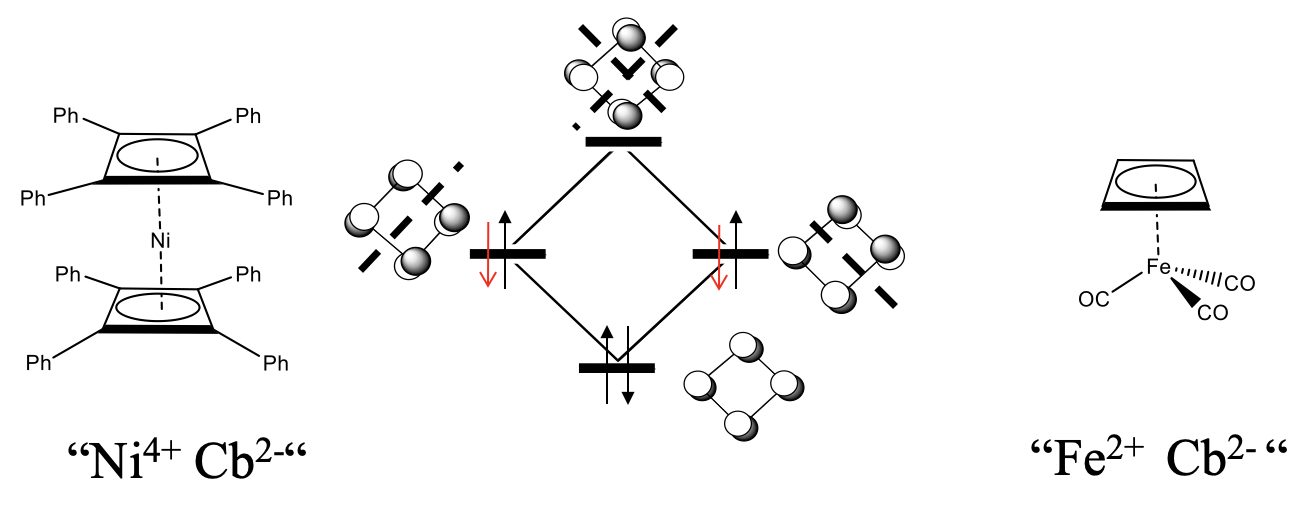
¿Qué sería un complejo sándwich de 18 electrones con dos ligandos de ciclobutadieno? Debido a que cada ciclobutadieno aporta cuatro electrones, diez electrones necesitarían provenir del metal, y esperaríamos un complejo de ciclobutadienilo de níquel Ni (Cb) 2. Este complejo no se conoce, pero los derivados sí. Por ejemplo, se conoce un complejo de Ni con dos ligandos de tetrafluenilbutadieno (Figura\(\PageIndex{27}\)). Otro ejemplo es el complejo butadieniltricarbonil hierro (0). Curiosamente, cuando el ciclobutadieno actúa como un ligando 4, entonces no se distorsiona, sino plano cuadrado. Una explicación es que podemos tratar formalmente el ligando de ciclobutadieno como un ligando Cb 2 que se une a un catión metálico. Por ejemplo en FeCB (CO) 3 el Fe sería un Fe 2 +, en el complejo de níquel, el níquel sería un Ni 4 +. El anión Cb 2 - sería formalmente aromático porque tiene 4n+2=6 electrones. Los dos electrones adicionales estarían en los orbitales no enlazantes. Debido a que los dos orbitales no vinculantes están completamente llenos ahora, ya no habría una fuerza impulsora para la distorsión. Tenga en cuenta que es sólo una visión formal, y hay argumentos que hablan en contra de este punto de vista. Una es que la adición de los dos electrones al ligando debería desestabilizar aún más el anillo debido a que los electrones añadidos no se unen. La aromaticidad se lograría más bien eliminando dos electrones para formar un catión Cb 2 + que tendría solo dos electrones en el orbital de unión.
Ciclooctetraeno (cot) como ligando
También se conocen metalocenos con ciclooctatetraeno (cot) actuando como 8-ligando. Sin embargo, debido al gran tamaño del anillo solo los metales con radios atómicos grandes, pueden hacer metalocenos con este ligando. Por ejemplo el uranio produce un uranocenos con dos ligandos de ciclooctatetraeno (Figura\(\PageIndex{28}\)).
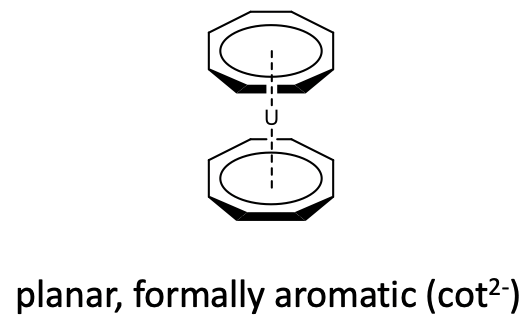
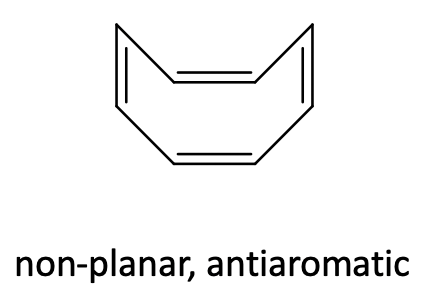
Al igual que el ciclobutadieno, el ciclooctatetraeno es un ligando antiaromático con 4n=8 electrones π-( n=2). En el ciclooctatetraeno libre la molécula no es plana y los electrones p están localizados (Figura\(\PageIndex{29}\)).
Sin embargo, en los metalocenos, el anillo se vuelve plano (Figura\(\PageIndex{28}\)). De nuevo se puede explicar formalmente que al asumir una cuna aromática 2 -ligando que se une a un catión metálico 2+, sin embargo se debe tener en cuenta nuevamente que esta es una visión formal y no necesariamente refleja la situación de unión en el compuesto.
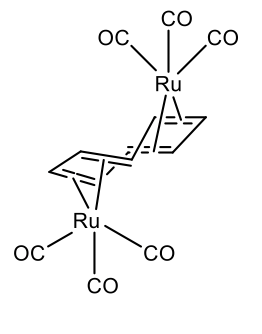
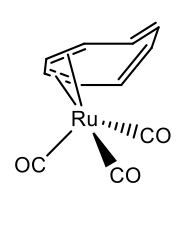
Los metales que tienen un radio atómico más pequeño pueden unirse a la cuna en 2, 4, y menos comúnmente en el modo 6. La regla de 18 electrones se mantiene en la mayoría de los casos. Por ejemplo, cot puede hacer un complejo 4 en tricarbonil ciclooctatetraeno rutenio (0) (Figura\(\PageIndex{30}\)).
También dos metales pueden unirse a un solo ligando de cuna. Esto se realiza por ejemplo en μ-ciclooctetraeno bis (tricarbonil rutenio (0) (Figura\(\PageIndex{31}\)).