10.2: Principios de los complejos carbonílicos
- Page ID
- 70079
Introducción en Complejos Carbonílicos
En este capítulo veremos más de cerca los complejos carbonílicos, a menudo simplemente llamados carbonilos. ¿Por qué? Son interesantes por una serie de razones. En primer lugar, son una clase bastante extensa de compuestos con una química de coordinación diversa. Aprenderemos que el ligando CO puede unirse a un metal de varias maneras, a veces no obvias. Además, los carbonilos se utilizan frecuentemente como materiales de partida para otros compuestos de coordinación. Esto se debe a que el ligando carbonilo no tiene carga y el monóxido de carbono es un gas. Debido a eso, una reacción de sustitución de ligando puede conducirse fácilmente hacia el lado derecho purgando CO fuera del recipiente de reacción. El CO es una unidad C 1, y esto se usa frecuentemente en catálisis con carbonilos. Los carbonilos son a menudo intermedios en reacciones que agregan un solo átomo de carbono a una cadena hidrocarbonada. Una propiedad fundamental fascinante de los carbonilos es que sus propiedades\(\pi\) aceptoras estabilizan los metales en números de oxidación bajos, a veces incluso negativos.
Adhesión en CO

Figura\(\PageIndex{1}\): Unión en la molécula de CO. Diagrama MO (izquierda) y estructura de enlace de valencia correspondiente (derecha). Para más explicaciones haga clic aquí.
El carbono en la molécula de CO es el extremo más reactivo, y así el CO prefiere unirse con el carbono a un metal, y no con oxígeno. Esto no es obvio porque el carbono es menos electronegativo que el oxígeno. La razón es que el HOMO de la molécula de CO es un orbital aproximadamente no enlazante que se localiza principalmente en el carbono (Figura\(\PageIndex{1}\)). En la imagen del enlace de valencia se asemeja al par electrón-solitario en el átomo de carbono. El par solitario de electrones en el oxígeno se asemeja al orbital molecular 2a 1 que tiene una energía significativamente menor, por lo que rara vez se usa en la unión. \(\pi\)Tanto los orbitales como los\(\pi\) *-orbitales son relativamente cercanos en energía al HOMO, y por lo tanto estos orbitales también pueden ser utilizados para la unión en carbonilos. Esto explica la diversa química de coordinación de los carbonilos.
Modos de unión a σdel ligando de carbonilo
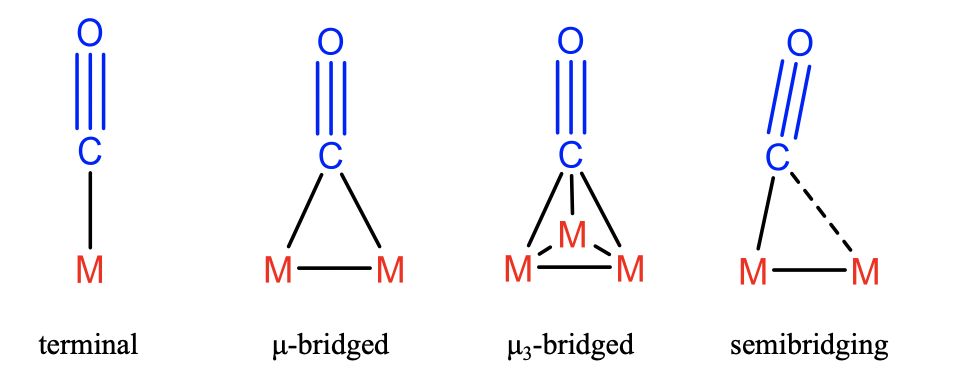
En el caso más simple el CO utiliza su par solitario de electrones en el carbono para unirse al átomo de metal único M (Figura\(\PageIndex{2}\)). En este caso llamamos al CO un ligando carbonilo terminal. Además, es posible que el par solitario de electrones se comparta entre dos o incluso tres metales que están interconectados a través de enlaces metal-metal. En estos casos, decimos que el CO actúa como un ligando\(\mu\) -puenteado, y\(\mu_3\) -brigada, respectivamente. Si dos metales mantenidos juntos por un enlace metal-metal son diferentes, entonces la interacción del CO con un metal puede ser más fuerte que con el otro. En este caso, el ligando CO actúa como ligando de semipuenteo. En todos estos casos el CO actúa como donante de 2 electrones porque dona sus dos electrones en el par solitario de electrones en el átomo de carbono.
Además del par solitario de electrones en el carbono, el ligando CO también puede usar sus\(\pi\) orbitales de unión para la donación de electrones en orbitales metálicos (Figura\(\PageIndex{3}\)). Sin embargo, estos electrones solo pueden usarse junto con el par solitario de electrones en C porque el par de electrones tiene una energía más alta que\(\pi\) los electrones, y los electrones de mayor energía siempre se usan primero. Por razones estéricas, el par solitario de electrones y\(\pi\) los electrones siempre se donan a diferentes metales que se mantienen unidos por enlaces metal-metal.
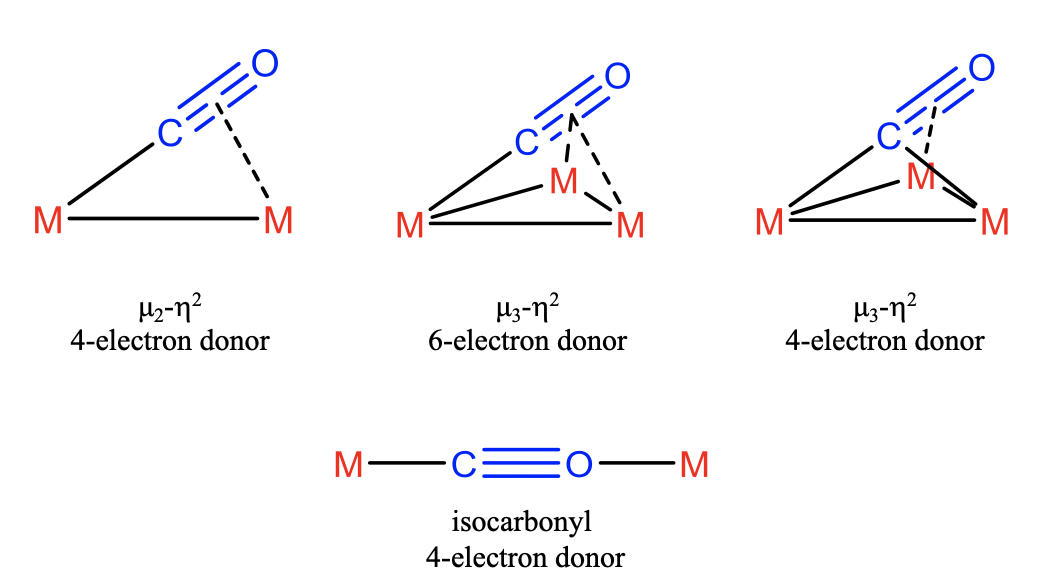
En el caso más simple, el ligando CO se une en\(\eta_2\) modo\(\mu_2\) - lo que implica que el par solitario de electrones se une a un metal y dos\(\pi\) electrones se unen a otro. En este caso el ligando CO actúa como donador de 4 electrones. Además, es posible que los cuatro\(\pi\) electrones estén involucrados en la unión además del par solitario de electrones. En este caso están involucrados tres átomos metálicos. El primero interactúa con el par electrón-solitario, el segundo con los dos\(\pi\) electrones y el tercero con los otros dos\(\pi\) electrones. Debido a que tres metales están puenteados y ambos átomos del ligando están involucrados en la unión con el metal podemos decir que el CO se une de\(\eta_2\) manera\(\mu_3\) - y actúa como un donador de 6 electrones. También es posible que el par electrón-solitario esté siendo compartido entre dos metales, y dos\(\pi\) -electrones sean donados al tercer metal. También en este caso el ligando se une de\(\eta_2\) manera\(\mu_3\) -, pero actúa como un donador de 4 electrones. Otra forma en que el ligando CO puede actuar como donador de 4 electrones es cuando actúa como ligando isocarbonilo. En este caso utiliza sus pares de electrones tanto en el C como en el O-átomos. Esto solo es posible cuando las circunstancias estéricas favorecen la utilización del par solitario de electrones O sobre los\(\pi\) electrones energéticamente superiores. Esto es raro.
\(\pi\)-Modos de unión del ligando de carbonilo
El ligando carbonilo puede usar sus\(\pi\) orbitales*-para unirse con orbitales d metálicos de\(\pi\) manera. El ligando actúa como un\(\pi\) -aceptor. Hay dos posibilidades para la encuadernación (Figura\(\PageIndex{4}\)).
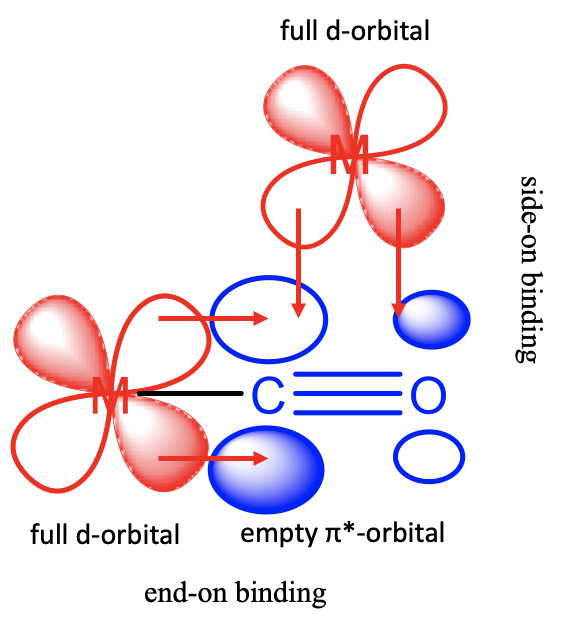
El primero ocurre cuando el Co-ligando actúa como un extremo de unión al ligando terminal. En este caso los dos lóbulos de los\(\pi\) orbitales *-en el carbono interactúan con los lóbulos de un d-orbital metálico. También los\(\pi\) orbitales de unión tienen la simetría correcta para superponerse con el d-orbital metálico en este modo, pero sus energías están mucho más alejadas de las de los orbitales d, por lo que estas interacciones pueden ser descuidadas. La segunda posibilidad es que el CO se una de lado a un metal-d-orbital. En este caso, un lóbulo en C y un lóbulo en O interactúan con el metal d-orbital. Estas interacciones son menos fuertes en comparación con las interacciones finales porque el solapamiento orbital es menos eficiente debido al tamaño desigual de los lóbulos de la órbita\(\pi\) *-orbital. El\(\pi\) orbital *-se localiza principalmente en el átomo de carbono porque el átomo de carbono es el átomo más electropositivo. Tenga en cuenta que los\(\pi\) orbitales de unión no tienen la simetría correcta para superponerse con un orbital metal-d de\(\pi\) manera, solo pueden superponerse en forma σcuando la unión es lateral.
El modelo Dewar-Chatt-Duncanson
Las interacciones entre el donador y el\(\pi\) aceptor en los complejos carbonílicos se refuerzan sinérgicamente entre sí. Este efecto sinérgico se llama el modelo Dewar-Chatt-Ducanson para carbonilos. ¿Cómo podemos entender las interacciones sinérgicas? Consideremos un ligando carbonilo que se une de extremo a un metal.

Veamos primero las interacciones σ-donante. El par solitario de electrones en el carbono dona densidad electrónica en d-orbitales metálicos vacíos y se forma un enlace dativo entre el metal y el carbono. La densidad de electrones donados mejora la energía de los electrones d metálicos debido al aumento de la repulsión electrón-electrón. Debido a su mayor energía, los electrones d son aceptados más fácilmente por el ligando carbonilo a través de las interacciones\(\pi\) -aceptores. Las interacciones\(\pi\) -aceptor aumentan el orden de enlace entre el metal y el enlace de carbono. Al mismo tiempo, el orden de enlace entre el carbono y el oxígeno disminuye debido a que la densidad de electrones se ha transferido del metal a los\(\pi\) orbitales *-( Figura\(\PageIndex{5}\)).
La fuerza de las interacciones\(\pi\) -aceptor puede diferir significativamente en carbonilos. Se pueden dibujar tres estructuras diferentes para interacciones débiles, intermedias y fuertes\(\pi\) -aceptores (Figura\(\PageIndex{6}\) a\(\PageIndex{8}\)).

Cuando solo están presentes interacciones débiles, podemos representar el enlace M-C como un enlace sencillo y el enlace C-O como un triple enlace.

Cuando las interacciones tienen fuerza intermedia podemos representar tanto el enlace M-C como el enlace C-O como dobles enlaces.

Cuando las interacciones\(\pi\) -aceptor son fuertes entonces el enlace M-C se convierte en un triple enlace y el enlace C-O se convierte en un enlace sencillo.
¿De qué depende la fuerza de las interacciones\(\pi\) -aceptor? Depende mayormente de la carga sobre el carbonilo. Los cationes carbonilo con una carga de +2 o superior tienden a tener interacciones débiles\(\pi\) -aceptores. Los carbonilos neutros o carbonilos con una carga +1 o -1 tienen interacciones\(\pi\) aceptoras intermedias. y aquellos con una carga negativa de 2- o superior tienen interacciones\(\pi\) aceptoras fuertes. De esto se puede ver que cuanto menor es la carga positiva y mayor es la carga negativa, mayor es el orden de enlace metal-carbono y más fuerte es el enlace metal-carbono. Como consecuencia, las cargas negativas tienden a estabilizar los carbonilos, mientras que las cargas positivas los desestabilizan. Por lo tanto, los aniones carbonilato tienden a ser más estables en comparación con los cationes carbonilo. La estabilidad de los carbonilos neutros es intermedia.
Carbonilos Homolépticos de los Metales de Transición
Después de haber entendido los principios de la unión en los carbonilos, pensemos a continuación en qué estructuras hacen los carbonilos de metales de transición. Las estructuras siguen principalmente la regla de 18 electrones. Para los carbonilos homolépticos más simples, en los que el ligando carbonilo se une terminalmente al metal de transición actuando como un donador de dos electrones, simplemente ensamblaríamos tantos ligandos como fuera necesario hasta que tengamos 18 electrones. Esto nos daría el número de coordinación en el carbonilo del que podríamos deducir la estructura. Esto funciona bien para metales de transición con un número par de electrones de valencia.

En este caso el número de ligandos x es apenas 18 menos el número de electrones metálicos dividido por 2. Por lo tanto, esperaríamos un carbonilo mononuclear del tipo M (CO) x (Figura\(\PageIndex{9}\)). Para los metales con un número impar de electrones, la situación es más complicada porque un número impar por dos multiplicado por un número entero nunca da 18. En este caso, se añaden al metal tantos ligandos x como sea necesario para elaborar un complejo de 17 electrones de valencia, y luego el complejo de 17 electrones de valencia se dimeriza para formar un carbonilo dinuclear de la composición M2 (CO) x. Una excepción es el vanadio. Hace un electrón de 17 valencia vanadio hexacarbonilo que no dimeriza porque un número de coordinación de 7 no es favorable.
Carbonilos homolépticos del 6º grupo (M = Cr, Mo, W)
Ahora veamos más de cerca los carbonilos con metales con un número par de electrones. Podemos comenzar con el grupo 6 que contiene los elementos cromo, molibdeno y tungsteno. Nuestra tarea es determinar la composición y estructura de los carbonilos.

De acuerdo con la regla de 18 electrones necesitamos 18 electrones en general. ¿Cuántos son aportados por el metal? Debido a que los metales están en el grupo 6, todos tienen seis electrones. Los carbonilos no llevan carga, por lo que no hay electrones que restar o agregar. ¿Cuántos electrones ligando necesitamos para llegar a 18? Bueno, eso es 18-6=12 electrones. ¿Cuántos ligandos de carbonilo se necesitan entonces? Debido a que cada ligando es considerado un donador de dos electrones, necesitamos 12/2=6 ligandos. Por lo tanto, la composición del carbonilo será M (CO) 6. El carbonilo adopta forma octaédrica para maximizar la distancia de los ligandos entre sí. Los carbonilos del grupo 6 son sólidos incoloros, cristalinos y sublimables.
Carbonilos octaédricos cargados con 18 electrones
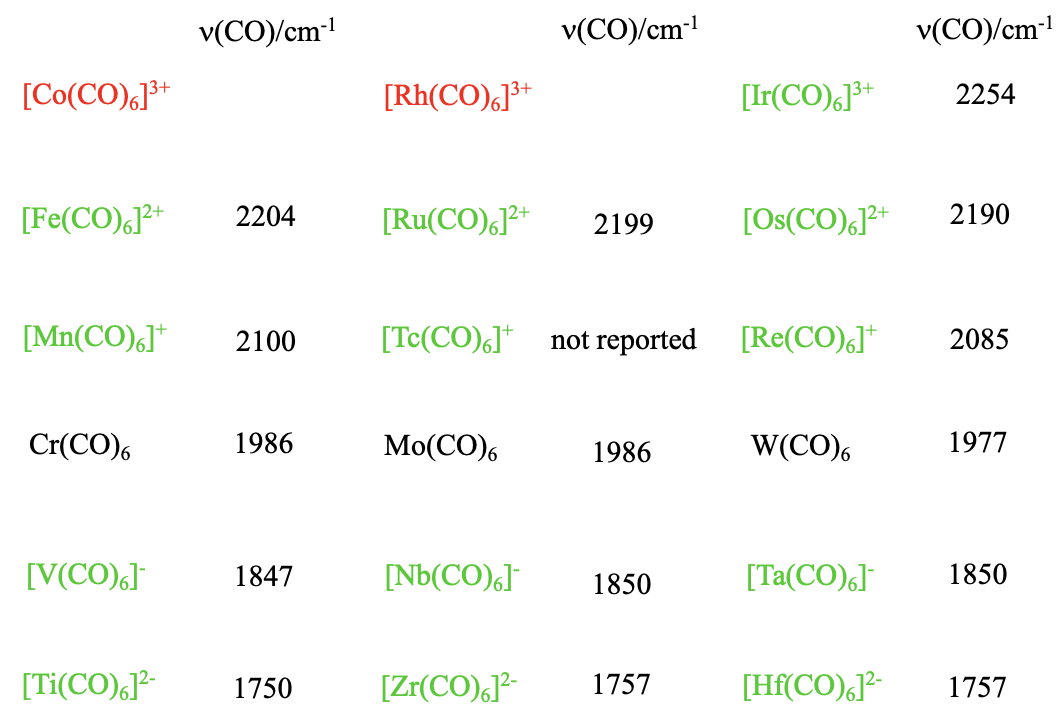
¿También hay otros 18 e carbonilos del tipo M (CO) 6 con otros metales pero metales del grupo 6? Sí, pero la carga en el carbonilo necesita ser ajustada para que el complejo tenga 18 electrones. Por ejemplo, podemos reemplazar Cr por V, pero luego el necesitamos una 1- carga que da como resultado un carbonilato de la fórmula V (CO) 6 -. ¿Por qué? El vanadio está en el grupo 5 y tiene un electrón menor que el cromo. Por esa razón, debemos agregar un electrón que le da al complejo una carga de 1-. También se conocen los homólogos superiores Nb (CO) 6 - y Ta (CO) 6 -. ¿Y si vamos más a la izquierda en la tabla periódica? El titanio se deja al vanadio, y tiene cuatro electrones de valencia. Por lo tanto, el electrón de valencia 18 hexacarbonilo del titanio tiene una carga 2-, y la fórmula es Ti (CO) 6 2-. De nuevo, también se conocen los homólogos superiores de Ti (CO) 6 2-, el Zr (CO) 6 2- y el Hf (CO) 6 2-. ¿También podemos ir a la derecha en la tabla periódica? El manganeso se asienta a la derecha del cromo. El manganeso tiene un electrón más que el cromo, por lo tanto el hexacarbonilo de 18 electrones del manganeso debe ser un catión carbonilo con una carga 1+, y la fórmula es Mn (CO) 6 2+. De los homólogos superiores, también se conocen tanto el Tc (CO) 6 + como el Re (CO) 6 +. A la derecha del Mn, está el Fe que tiene 8 electrones de valencia. Por lo tanto, el hierro hexacarbonilo de 18 electrones debe tener una carga 2+, y la fórmula es Fe (CO) 6 2+. También se conocen los homólogos superiores Ru (CO) 6 2+ y Os (CO) 6 2+. ¿Podemos ir aún más lejos a la izquierda, a la Co? La fórmula esperada para Co carbonilo sería Co (CO) 6 3+, pero no se conoce, y tampoco lo es el homólogo superior, el Rh (CO) 6 3+. Sólo se ha aislado el Ir (CO) 6 3+. Esto refleja una tendencia general en la química del carbonilo. Las cargas positivas desestabilizan el carbonilo, y los carbonilos con cargas positivas altas frecuentemente no son estables. Por otro lado, las cargas negativas estabilizan un carbonilo e incluso los carbonilatos con altas cargas negativas son estables. Podemos explicar esto fácilmente por el hecho de que el orden de unión entre el metal y el carbono disminuye con el aumento de la carga positiva, y aumenta con el aumento de la carga negativa. El aumento del orden de enlace fortalece la estabilidad del carbonilo. De esto vemos que las propiedades\(\pi\) -aceptoras son bastante importantes para la estabilidad de los carbonilos. También vemos que en los carbonilatos los números de oxidación de los metales son negativos. Los números de oxidación negativa son bastante inusuales para los metales. Se concluye que el ligando carbonilo tiene la propiedad inusual de estabilizar el metal en estados de oxidación negativa.
¿Hay alguna manera de medir fácilmente el orden de fianza de un bono M-C? Podemos hacer esto indirectamente midiendo el espectro IR del carbonilo. Debido a que el orden de unión del enlace C-O disminuye al aumentar el orden de unión para el enlace M-C, el número de onda para la vibración de estiramiento C-O se puede usar como una medida para el orden de unión M-C. Cuanto menor sea el número de onda, menor será el orden de enlace C-O y mayor será el orden de enlace M-C. Cuando observamos los números de los diferentes carbonilos dentro de un periodo vemos que, como se esperaba, los números de onda aumentan al aumentar el número de grupos indicando un orden de enlace decreciente. También podemos mirar hacia abajo a los grupos. Vemos que en este caso, los números apenas cambian, es decir, que el orden de unión apenas se ve afectado por el periodo del metal.
Carbonilos Homolépticos del 8º Grupo (Fe, Ru, Os)
¿Qué carbonilos de carga neutra esperaríamos para el grupo 8 elementos Fe, Ru y Os?

En general, estos carbonilo necesitan tener 18 electrones. En este caso los metales tienen 8 electrones. El cargo es 0. Esto significa que tendríamos 18-8=10 electrones que necesitarían provenir del ligando. Por lo tanto, el número de ligandos necesarios sería 10/2=5. Así, esperaríamos pentacarbonilos de la composición M (CO) 5 (Figura\(\PageIndex{12}\)). Estos carbonilos adoptan la forma trigonal-bipiramidal. Los carbonilos del grupo 8 son todos líquidos. El pentacarbonilo de hierro tiene un color naranja claro mientras que los carbonilos de rutenio y osmio son incoloros.
Carbonilos trigonal-bipiramidales cargados con 18 electrones
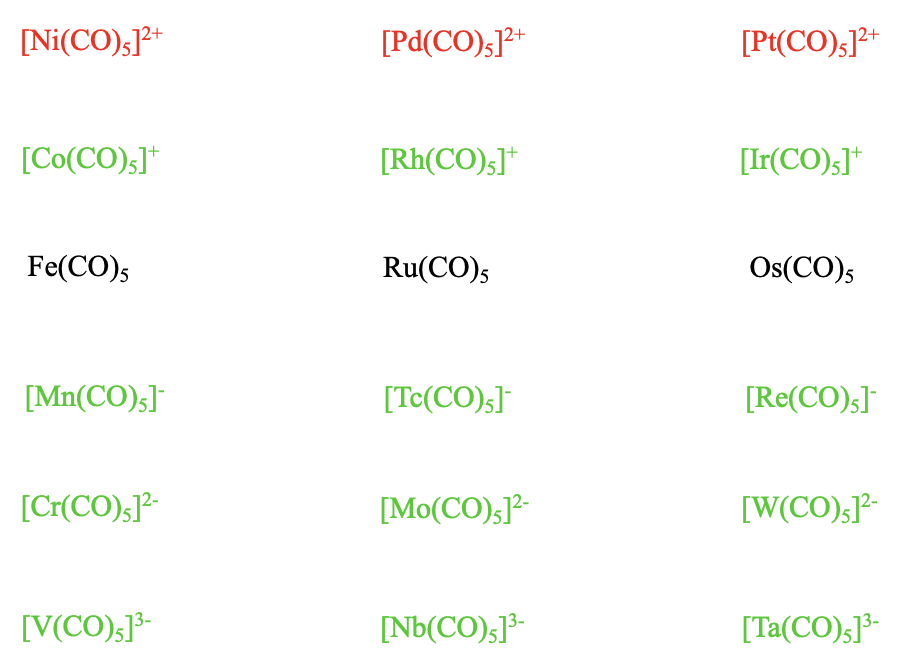
Podemos volver a preguntar si hay pentacarbonilos isostéricos cargados con 18 e de metales distintos de los metales del grupo 8. La respuesta es sí. El manganeso se deja al hierro en la tabla periódica y tiene un electrón menos. Por lo tanto su pentacarbonilo necesita tener una carga 1- y la composición es Mn (CO) 5 -. También existen los homólogos superiores, el Tc (CO) 5 -y el Re (CO) 5 -. El Cr tiene un electrón menor que el Mn, por lo tanto su pentacarbonilo tiene una carga 2- y la fórmula es Cr (CO) 5 2-. También se conocen Mo (CO) 5 2- y W (CO) 5 2-. El vanadio tiene otro electrón menos porque está en el 5to grupo, por lo tanto su pentacarbonilo tiene una carga 3-, y la fórmula es V (CO) 5 3-. Nuevamente, los homólogos superiores, el Nb (CO) 5 3- y el Ta (CO) 5 3- también son estables. También para los pentacarbonilatos, las altas cargas negativas no son problema para la estabilidad de los complejos debido al efecto estabilizador de las interacciones\(\pi\) -aceptor. ¿Qué pasa con los cationes carbonilo con forma bipiramidal trigonal? A medida que vamos de Fe a Co, necesitamos una carga 1+ en el carbonilo para lograr 18 electrones. El respectivo catión Co (CO) 5 + es estable, y también lo son sus homólogos superiores, el Rh (CO) 5 + y el Ir (CO) 5 +. Sin embargo, los cationes pentacarbonilo del grupo 10 Ni (CO) 5 2+, Pd (CO) 5 2+ y Pt (CO) 5 2+ no son estables. La carga positiva 2+ debilita demasiado el enlace metal-carbono. Este comportamiento es consistente con el debilitamiento del enlace M-C con el aumento de la carga positiva debido a los efectos\(\pi\) aceptores más débiles.
Carbonilos homolépticos del grupo 10 (Ni, Pd, Pt)
¿Y qué pasa con los carbonilos del grupo 10?

En este caso los metales tienen 10 electrones. No hay ningún cargo. El número de electrones ligando necesarios es 18-10 = 8 electrones. Así, el número de ligandos es 8/2=4. Por lo tanto, la composición es M (CO) 4 (Figura\(\PageIndex{14}\)). La forma es tetraédrica porque tenemos un complejo de electrones de valencia 18 y no 16. El tetracarbonilo de níquel es un líquido volátil e incoloro. Los homólogos superiores, el Pd (CO) 4 y el Pt (CO) 4 no son estables. Podemos explicar esto al recordar que el solapamiento\(\pi\) -orbital en los complejos tetraédricos es generalmente débil. Por lo tanto, el enlace de carbono M-C se estabiliza de manera menos efectiva por las interacciones\(\pi\) -aceptor en comparación con los carbonilos octaédricos y trigonal-bipiramidales. Este efecto es aún más pronunciado para los carbonilos Pd y Pt porque tienen orbitales más grandes que pueden superponerse aún menos eficazmente con los\(\pi\) orbitales *-relativamente pequeños del ligando CO. En este caso las interacciones\(\pi\) -aceptor son tan débiles que la molécula entera ya no es estable.
Carbonilos Tetraédricos Cargados con 18 electrones

¿Qué pasa con los carbonilos tetraédricos de 18 electrones cargados con otros metales? Nuevamente, los carbonilatos cargados negativamente son estables, incluso con altas cargas negativas. Co (CO) 4 -, Fe (CO) 4 2-, Mn (CO) 4 3-, y Cr (CO) 4 4- son todos estables y también lo son sus homólogos superiores. También se conoce el Cu (CO)) 4 + que tiene una carga positiva 1+, pero sus homólogos superiores, el Ag (CO) 4 + y el Au (CO) 4 + no lo son.
Tendencias generales de estabilidad

En general, la estabilidad de los carbonilos tiende a disminuir del grupo 6 al grupo 8 al grupo 10 (Figura\(\PageIndex{16}\)). Esta tendencia se debe a que la forma octaédrica permite el mejor solapamiento orbital para las interacciones\(\pi\) -aceptor, seguida por la bipiramidal trigonal, seguida de la forma tetraédrica. La estabilidad también tiende a disminuir del 4to al 6to periodo. Esta tendencia puede explicarse por un solapamiento orbital menos eficiente debido al tamaño orbital cada vez más diferente entre el ligando y los orbitales metálicos. Estos efectos son suficientemente grandes para que Pd (CO) 4 y Pt (CO) 4 los hagan inestables.
Grupo 4 y Grupo 12 Carbonilos (no existentes)
Hemos discutido los grupos 6, 8 y 10 carbonilos, pero no el grupo 4 y el grupo 12. ¿Por qué? Porque ningún carbonilos de estos grupos es estable. ¿Cuál es la razón? Para los carbonilos del grupo 4, necesitaríamos siete ligandos de carbonilo. Esto llevaría a un número de coordinación de siete que es inaceptablemente alto para los carbonilos. Para los carbonilos del grupo 12, solo necesitaríamos tres ligandos carbonilo. Esto conduciría a un número de coordinación inaceptablemente bajo de 3.
Carbonilos homolépticos del 7º grupo (M = Mn, Tc, Re)
Ahora pensemos en qué estructuras se forman los carbonilos homolépticos con metales que tienen un número impar de electrones. Comencemos con el séptimo grupo que consiste en los metales Mn, Tc y Re. Nuestro enfoque es ver cuántos ligandos necesitamos para producir un fragmento de electrones de 17 valencia, y luego dimerizar ese fragmento.
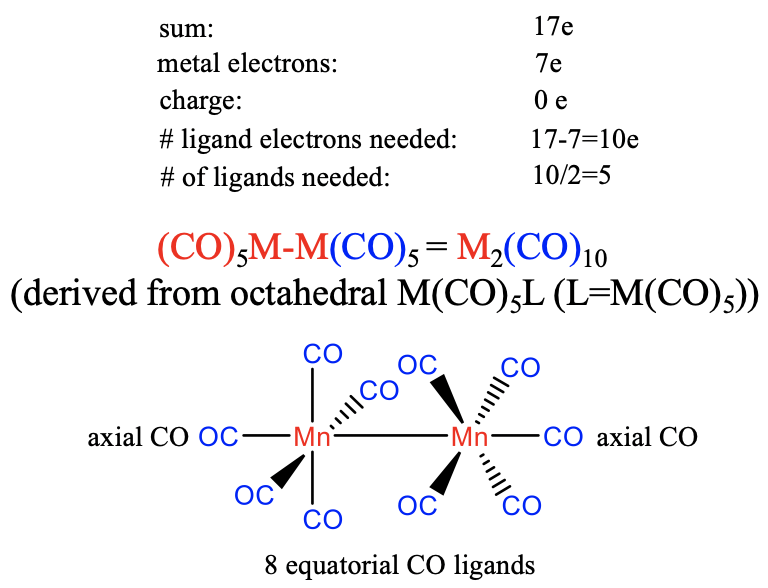
Los metales del grupo 7 tienen siete electrones de valencia. Nuevamente, asumiremos que no hay carga sobre el carbonilo. El número de electrones ligando para producir el fragmento de 17 electrones de valencia será, por lo tanto, 17-7 = 10. El número de ligandos necesarios es, por lo tanto, 10/2=5 asumiendo que el ligando carbonilo es un extremo de unión donador de 2 electrones al metal. Esto da un fragmento M (CO) 5 que se dimeriza para formar un carbonilo M2 (CO) 10 con un enlace metal-metal. Se puede pensar que la estructura deriva de una estructura octaédrica en la que cada metal está rodeado octaédricamente por cinco ligandos de CO y un fragmento M (CO) 5 que actúa como sexto ligando. Cada unidad M (CO) 5 tiene un ligando axial y cuatro ligandos ecuatoriales, por lo que el ligando axial es codireccional con el enlace metal-metal. Los cuatro ligandos ecuatoriales del primer metal están en conformación escalonada en relación con los cuatro ligandos ecuatoriales del segundo metal debido a argumentos de repulsión estérica.
Carbonilos Isoelectrónicos Cargados del Tipo M 2 (CO) 10
¿Podemos hacer carbonilos isoelectrónicos cargados del tipo M 2 (CO) 10 con otros metales? La respuesta es sí, pero solo aniones carbonilados con baja carga negativa, y sin cationes carbonilo. La formación de cationes carbonilo está prohibida debido al debilitamiento de las interacciones\(\pi\) -aceptores que resultan de la carga positiva. Las altas cargas negativas no son posibles porque demasiadas cargas negativas en los átomos metálicos conducen a la repulsión electrostática y la desestabilización de los enlaces metal-metal.
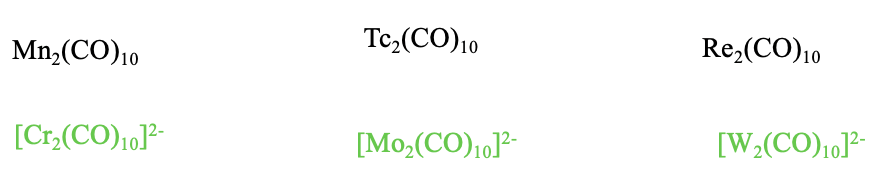
Por lo tanto, solo hay Cr 2 (CO) 10 2-, y los homólogos superiores Mo 2 (CO) 10 2- y W 2 (CO) 10 2-, pero no hay otros iones carbonilo de tipo M 2 CO 10.
Carbonilos homolépticos del 9º grupo (M = Co, Rh, Ir)
¿Cuáles son las estructuras esperadas para los carbonilos homolépticos del grupo 9?
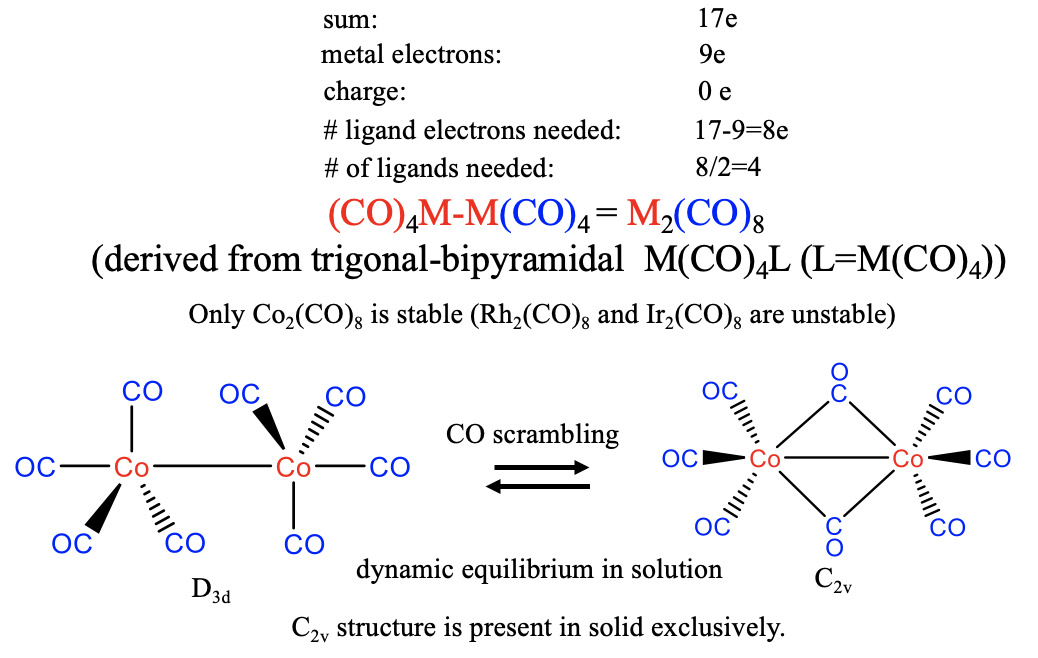
En este caso, el metal aporta 9 electrones, y esto significa que 17-9=8 electrones necesitan provenir del ligando carbonilo. Por lo tanto, necesitamos 8/2=4 moléculas de CO para producir un fragmento de electrones de valencia M (CO) 4 17. Dos de los fragmentos luego se dimerizan para formar un carbonilo dinuclear de la composición M 2 CO 8. En la naturaleza, sin embargo, solo se realiza el Co-carbonilo, los análogos de Rh e Ir son inestables. La estructura del carbonilo de Co 2 (CO) 8 puede derivarse de una pirámide trigonal de M (CO) 4 L, donde L es la segunda unidad M (CO) 4 (Fig. 10.2.19). Según eso, el número de coordinación es 5. Hay dos ligandos axiales y seis ecuatoriales, por lo que los ligandos ecuatoriales se orientan en una conformación escalonada. En solución, esta estructura está en equilibrio dinámico con una segunda estructura con simetría C 2v en la que dos ligandos de CO están puenteando. Debido a este equilibrio existe una constante aleatorización de ligandos, lo que significa que los ligandos CO se mueven constantemente de posiciones axiales a ecuatoriales, y migran de un átomo de metal a otro. En estado sólido la estructura tipo C 2v está presente exclusivamente indicando que es ligeramente más estable.
Carbonilos Isoelectrónicos Cargados del Tipo M 2 (CO) 8
Los carbonilos isoelectrónicos cargados del tipo M 2 (CO) 8 se comportan de manera similar a los del tipo M 2 (CO) 10. No hay aniones carbonilados binucleares altamente cargados, ni cationes carbonilo.
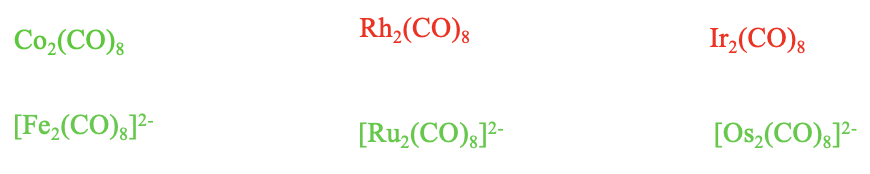
Solo están los débilmente cargados negativamente [Fe 2 (CO) 8] 2-, [Ru 2 (CO) 8] 2-, y [Os 2 (CO) 8] 2-. La carga débilmente negativa estabiliza el enlace metal-carbono sin desestabilizar demasiado el enlace metal-metal. Podemos ver además a partir de esto que una carga débilmente negativa es mejor para la estabilidad de la especie que ninguna carga en absoluto.
Carbonilos Homolépticos del XI Grupo (M = Cu, Ag, Au)
El grupo 11 metales Cu, Ag y Au tienen once electrones de valencia.
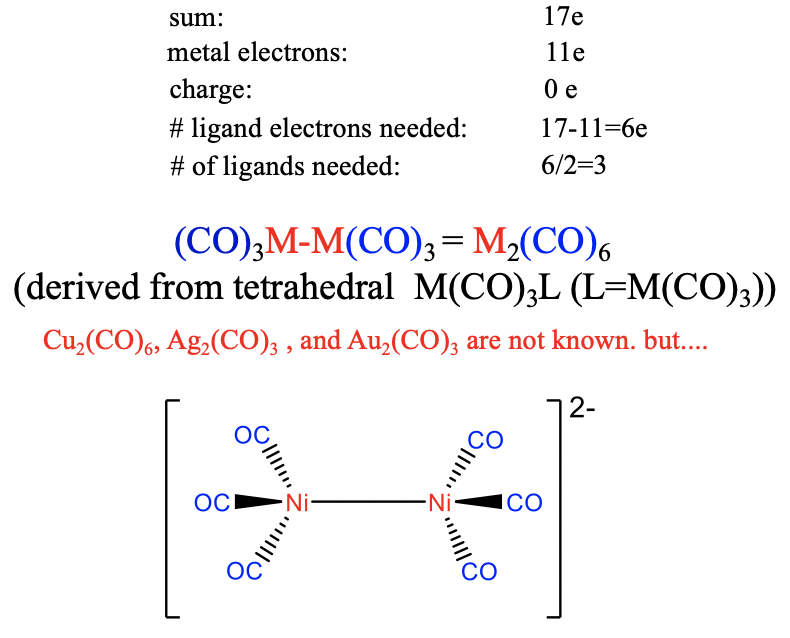
Por lo tanto, se necesitan seis electrones ligando para lograr 17 electrones (Figura\(\PageIndex{21}\)). Esto significa que se requieren ligandos de CO 6/2=3 para producir el fragmento de electrones de 17 valencia. El dímero del mismo tiene la composición M2 (CO) 6 y su estructura puede derivarse de una estructura tetraédrica M (CO) 3 L en la que L es el segundo fragmento M (CO) 3. Ni el Cu, ni el Ag, ni el carbonilo Au se conocen debido al débil\(\pi\) solapamiento en la coordinación tetraédrica. Sin embargo, se conoce el ion [Ni 2 (CO) 6] 2- débilmente negativo, lo que puede explicarse por el efecto estabilizador de una carga negativa sobre el enlace M-C.
Tendencias generales de estabilidad
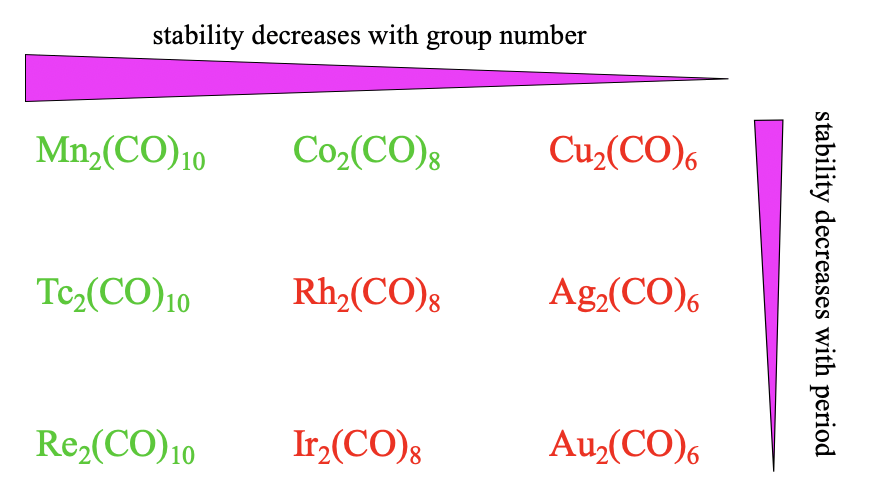
En general, vemos las mismas tendencias de estabilidad para los carbonilos dinucleares en comparación con los mononucleares. La estabilidad disminuye con el número de grupo porque\(\pi\) -superposición se vuelve más pequeña con números de coordinación más pequeños. También, vemos que la estabilidad disminuye con el periodo debido a la disminución de la coincidencia de tamaños orbitales.
Carbonilos homolépticos del 5º grupo (M = V, Nb, Ta)
El fragmento electrónico de 17 valencia del carbonilo de vanadio tiene la composición V (CO) 6. No dimeriza porque el número de coordinación de 6 es mucho más favorable en comparación con el número de coordinación 7. V (CO) 6 es un radical violeta oscuro de forma octaédrica. El electrón radical es estéricamente inactivo. V (CO) 6 se puede utilizar como oxidante ya que se puede reducir fácilmente a las 18 especies de electrones de valencia V (CO) 6 -. Se desconocen los homólogos superiores Nb (CO) 6 y Ta (CO) 6. Esto puede explicarse por el solapamiento orbital más débil entre los\(\pi\) orbitales *-relativamente pequeños del ligando carbonilo y los orbitales d metálicos grandes de Nb y Ta.

