12.2: Catalizadores organometálicos
- Page ID
- 70128
Compuestos organometálicos como catalizadores de hidrogenación
Las inserciones migratorias juegan un papel importante en la catálisis.
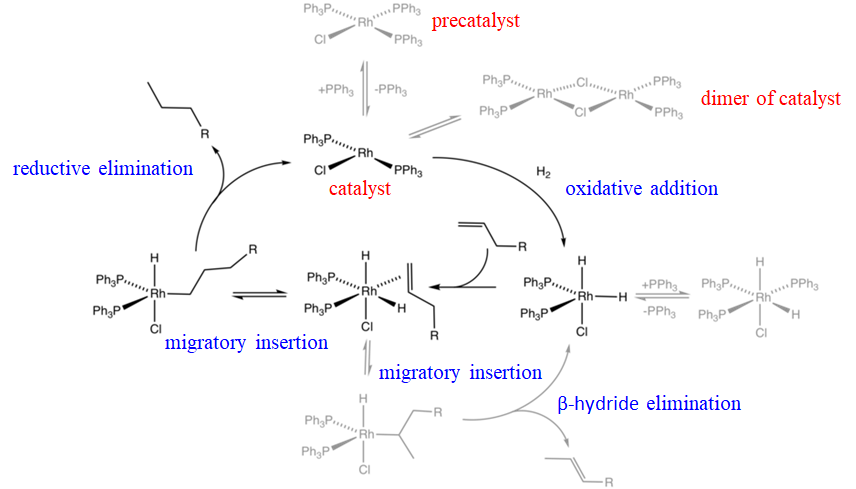
Por ejemplo, un catalizador Rh llamado catalizador de Wilkinson es un catalizador de hidrogenación eficaz para olefinas. El mecanismo de hidrogenación implica una combinación de adiciones oxidativas, inserciones migratorias de olefinas y eliminaciones reductoras (Fig. 12.2.2). El catalizador de Wilkinson es el complejo plano cuadrado de cloro tris (trifenilfosfina) rodio (I). Esta molécula es en realidad un precatalizador que se convierte en el catalizador real cuando pierde estadísticamente un ligando de trifenilfosfina produciendo cloro bis (trifenilfosfina) rodio (I). La pérdida de este ligando es una reacción reversible, y así el catalizador está en equilibrio químico con el precatalizador. El catalizador realmente está en un segundo equilibrio químico con su dímero. El catalizador de cloro bis (trifenilfosfina) rodio (I) puede sufrir una adición oxidativa en presencia de hidrógeno para formar un complejo trigonal bipiramidal clorodihidrido bis (trifenilfosfina) (III) rodio. Esta especie se encuentra en equilibrio químico con una especie octaédrica clorodihidrido tris (trifenil fosfina) rodio (III) que se puede formar debido a la presencia de ligandos de trifenilfosfina libres en el sistema. La especie bipiramidal trigonal puede entonces añadir una olefina que se une de lado a la Rh. Debido a que la olefina está en posición cis con respecto al ligando hidruro, puede sufrir una inserción de olefina. El enlace Rh-C puede formarse con el primer o el segundo carbono en la cadena carbonada de la olefina, dando un complejo alquilo lineal y uno ramificado, respectivamente. El complejo ramificado puede sufrir una eliminación de β-hidruro, reformando así el complejo Rh bipiramidal trigonal y una olefina. Esta reacción es una reacción secundaria porque el complejo de alquilo ramificado está estéricamente más abarrotado que el complejo lineal. El complejo de alquilo lineal Rh puede sufrir una eliminación reductora para formar el alcano lineal y el catalizador de RHCl (PPh 3) 2. Esto completa el ciclo catalítico y puede comenzar un nuevo ciclo.
Polimerización Ziegler-Natta
Otro ejemplo de una reacción catalítica organometálica es la polimerización de olefinas Ziegler-Natta. Esta reacción es de gran importancia industrial para la producción de olefinas como el polietileno. Existen catalizadores Ziegler-Natta heterogéneos y homogéneos. El mecanismo para los catalizadores homogéneos es generalmente bien entendido. Los catalizadores homogéneos son típicamente catalizadores de metaloceno.
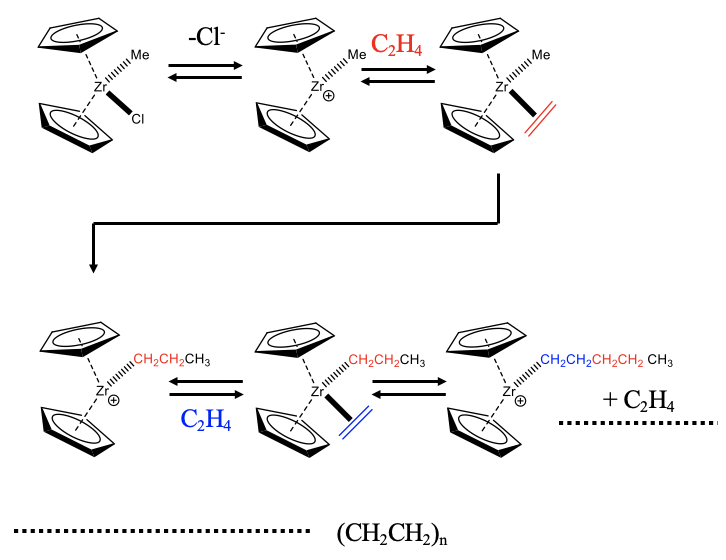
Se muestra un ejemplo de un catalizador a base de circonio (Fig. 12.2.3). El catalizador es un catión complejo coordinadamente insaturado con dos anillos de ciclopentadienilo y un grupo metilo. El catalizador se forma a partir de su precatalizador, una molécula neutra con un ligando cloro adicional. El catalizador añade oxidativamente una olefina como una molécula de etileno al sitio coordinativamente insaturado. A esta etapa se le sigue una etapa de inserción de olefina que produce un grupo propilo. La inserción migratoria conduce a la formación de un sitio vacante, que puede ser reocupado por otra molécula de etileno. Esta molécula puede insertarse en la cadena de propilo prolongando así la cadena de propilo a una cadena de pentilo. La etapa de inserción de olefinas genera otro sitio vacante que puede ser reocupado por una nueva molécula de etileno. Repitiendo el ciclo catalítico muchas veces eventualmente conduce al polietileno.
Hidroformilación catalítica de olefinas
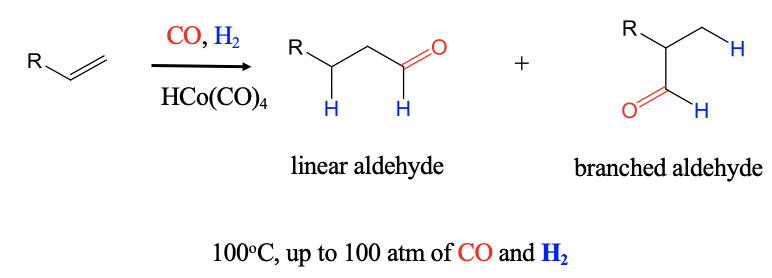
Otra reacción industrial importante es la reacción de hidroformilación catalítica, también conocida como oxo-proceso. Fue descubierto en 1938 por Otto Roelen en BASF. En la reacción de hidroformilación se añaden un átomo de H y un grupo formilo a un alqueno para formar aldehídos. La reacción puede producir aldehídos ramificados y lineales a partir de alquenos terminales, CO y H 2 usando hidruros de carbonilo como HCO (CO) 4 como catalizador. La reacción se realiza a aproximadamente 100°C a una presión de hasta 100 atm.
Mecanismo de la Hidroformilación Catalítica de Olefinas por HCO (CO) 4
¿Cómo funciona la hidroformilación mecanísticamente?
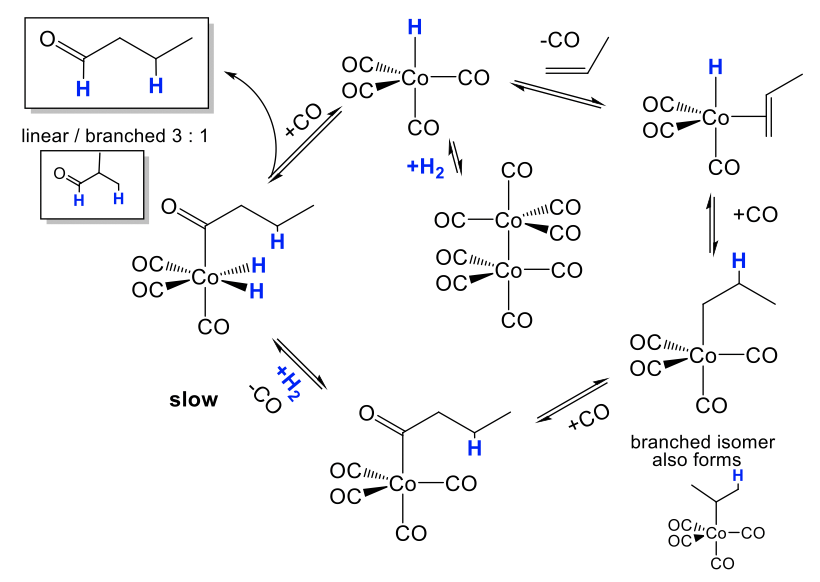
Se ilustra el mecanismo para la hidroformilación del propeno (Fig. 12.2.5). El catalizador real HCO (CO) 4 se forma primero a partir de su precatalizador Co 2 (CO) 8 en presencia de H 2 en una reacción de adición oxidativa dinuclear. El catalizador puede experimentar una reacción de sustitución en la que un ligando de CO es reemplazado por la olefina que se une de lado al cobalto. Esta especie puede entonces someterse a una reacción de inserción de olefinas migratorias. Esto conduce a una mezcla de grupos alquilo lineales y ramificados unidos al Co. Se puede agregar un nuevo ligando de CO al sitio vacante. El grupo alquilo puede entonces insertarse en un grupo carbonilo en otra etapa de inserción migratoria, y el sitio vacante puede ser reocupado por una nueva molécula de CO. Después, se agrega H 2 en una adición oxidativa. Esta es la etapa más lenta y limitante de velocidad en el ciclo catalítico. A partir del producto de adición, el aldehído se puede eliminar en una reacción de eliminación reductora. La adición de CO regenera el catalizador, y el ciclo catalítico puede comenzar de nuevo.
Hidrocarbonilaciones
Después de la hidroformilación, se desarrollaron otras hidrocarbonilaciones y se desplegaron industrialmente.
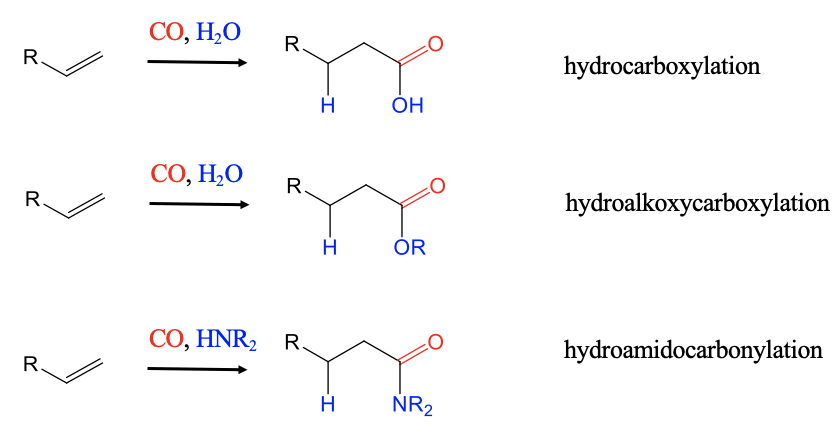
Cuando el hidrógeno es reemplazado por H 2 O, las hidrocarboxilaciones de los alquenos conducen a ácidos carboxílicos (Fig. 12.2.6). Con un alcohol en lugar de H 2 los hidroalcoxcarbonilcationes conducen a ésteres. El empleo de aminas en lugar de H 2 conduce a amidas en reacciones de hidroamidocarbonilación.
El proceso del ácido acético de Monsanto
Otra reacción de carbonilación que involucra un catalizador organometálico es el proceso de ácido acético de Monsanto. Ha sido introducido por Monsanto en la década de 1970 para la producción industrial de ácido acético a partir de metanol. La reacción implica catálisis dual con HI y [RhI 2 (CO) 2] - como co-catalizadores. ¿Cómo funciona esta reacción?
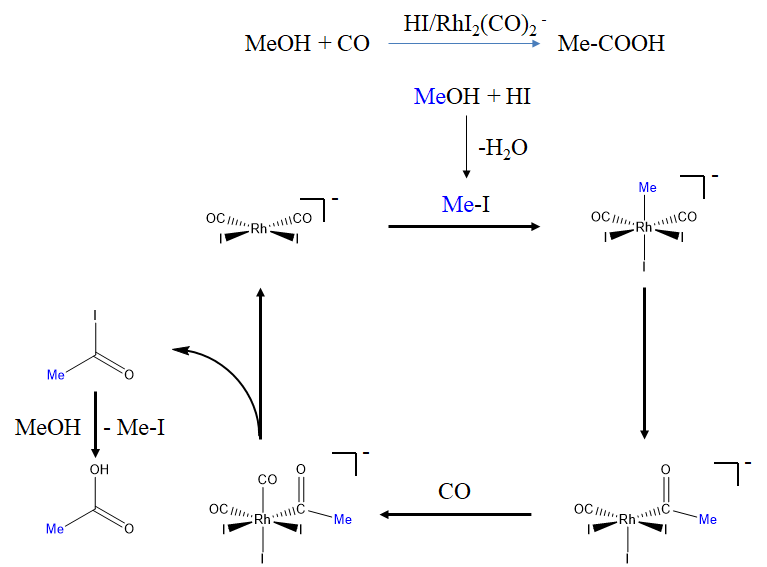
En la primera etapa el metanol reacciona con HI para formar yoduro de metilo. El yoduro de metilo reacciona entonces con el catalizador Rh en una reacción de adición oxidativa en la que un grupo metilo y un yodo se agregan en forma trans al complejo Rh cuadrado plano para dar un complejo octaédrico. El complejo octaédrico luego experimenta una reacción de inserción migratoria con CO produciendo un grupo acilo y un sitio vacante. Luego se puede agregar una molécula de CO al sitio vacante. El yoduro de acetilo se puede eliminar en una eliminación reductora para reformar el catalizador Rh cerrando así el ciclo catalítico. El yoduro de acetilo puede entonces reaccionar con metanol para formar nuevo yoduro de metilo y ácido acético. El yoduro de metilo puede iniciar un nuevo ciclo catalítico con el catalizador Rh.
Metátesis de Olefina
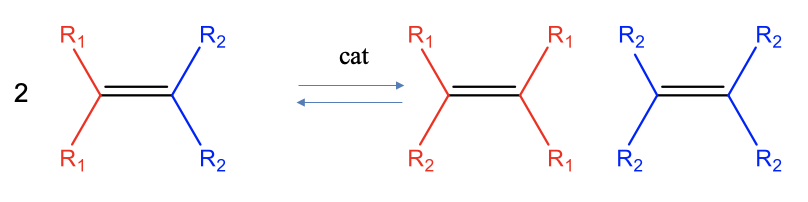
La metátesis de olefinas es una reacción que permite cortar y reorganizar dobles enlaces C=C en olefinas para hacer nuevas olefinas (Fig. 12.2.8). Formalmente, el enlace carbono-carbono del reactivo se escinde homolépticamente y los dos fragmentos de carbeno se combinan de manera diferente. Esta reacción es típicamente una reacción de equilibrio, y ni los reactivos ni los productos están claramente favorecidos. Esta reacción es catalizada por complejos de arilamido carbeno de molibdeno o complejos de rutenio carbeno.
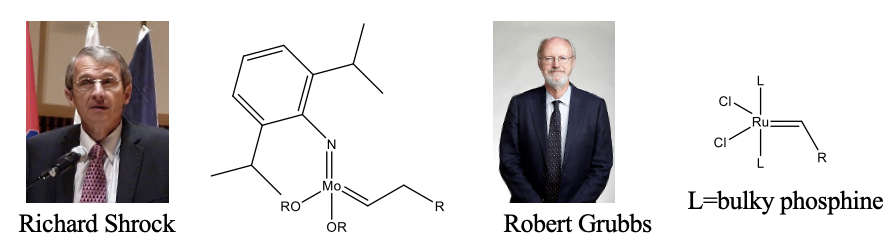
Los primeros se llaman catalizadores Shrock, y los segundos catalizadores de Grubbs llevan el nombre de sus descubridores Richard Shrock y Robert Grubbs quienes recibieron el premio Nobel de Química en 2005 (Fig. 12.2.9). Los catalizadores Schrock son más activos, pero también muy sensibles al aire y al agua. Los catalizadores Grubbs, aunque son menos activos, son menos sensibles al aire y al agua.
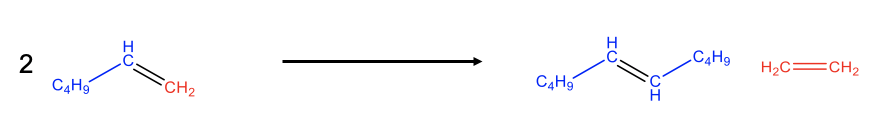
La metátesis de olefinas a menudo permite una preparación más simple de olefinas en comparación con otros métodos. La metátesis de olefinas es particularmente poderosa cuando un producto olefínico es gaseoso porque entonces se puede eliminar fácilmente del equilibrio químico purgando. Esto impulsa el equilibrio químico hacia el lado derecho. Un ejemplo es la preparación de 5-deceno a partir de 1-hexeno. La escisión del doble enlace C=C en el hexeno conduce a fragmentos de carbeno C 5 y C1 (Fig. 12.2.10). Los dos fragmentos C1 se pueden combinar para formar etileno y los dos fragmentos C 5 se combinan con 5-deceno. El etileno es volátil y se puede purgar del sistema de reacción, conduciendo así la reacción química hacia el lado derecho.
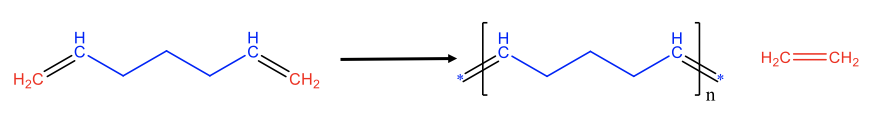
Los mismos principios también se pueden aplicar para producir polímeros a partir de dienos con dos dobles enlaces C=C terminales en los extremos de la cadena. Esto se denomina metátesis de dieno acílico (ADMET), Fig. 12.2.11. Por ejemplo, la escisión de los dos dobles enlaces terminales en un dieno con siete átomos de C conduce a fragmentos C1 y C5. Los fragmentos C1 pueden combinarse para formar etileno, y los fragmentos C 5 pueden combinarse para hacer un polímero insaturado del tipo [CH (CH 2) 3 CH] n. Nuevamente, la reacción puede conducirse hacia el lado derecho eliminando el etileno gaseoso de la mezcla de reacción a través de purga.
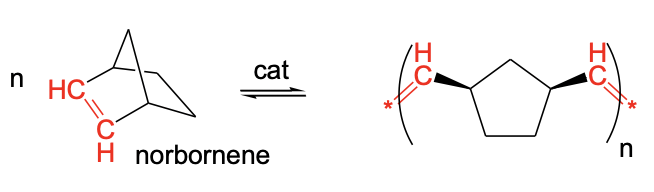
Otra variación de la metátesis de olefinas es la polimerización por metátesis de apertura de anillo (ROMP). Permite hacer polímeros a partir de cicloolefinas deformadas, por ejemplo norborneno. La fuerza impulsora de la reacción es el alivio de la tensión. Debido a que la deformación se elimina en el polímero, el equilibrio químico se encuentra lejos en el lado derecho. El producto de reacción en norborneno es un polímero con anillos de 5 miembros que están interconectados por unidades de etileno -CH=CH- (Fig. 12.2.12).
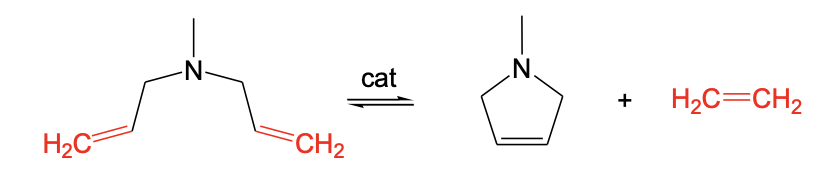
Lo opuesto a ROMP es la metátesis de cierre de anillo (RCM). RCM permite la preparación de anillos no tensos con dobles enlaces C=C a partir de dienos con dobles enlaces C=C que están separados por cinco o seis átomos de carbono. Esta distancia es adecuada para producir anillos no tensos. En el ejemplo mostrado se forma un anillo de cinco eslabones con un doble enlace C=C a partir de un dieno con dobles enlaces C=C terminales que están separados por cinco átomos.
El mecanismo de la metátesis de olefinas
¿Cuál es el mecanismo de la metátesis de olefinas?
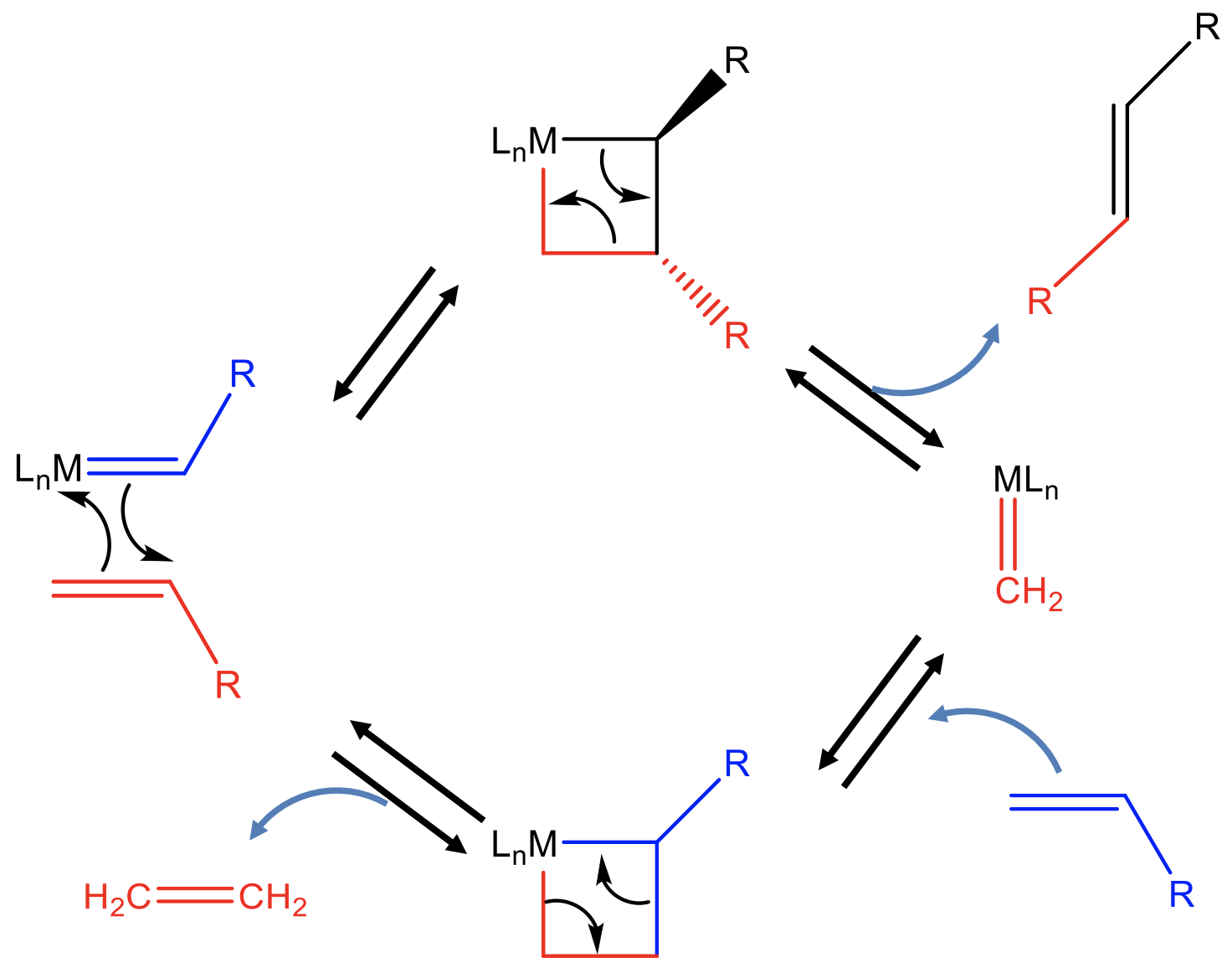
En la primera etapa, el alqueno se suma al fragmento de carbeno del catalizador en una reacción de cicloadición 2+2 para producir un intermedio inestable con un anillo de cuatro eslabones altamente colado (Fig. 12.2.14). Este anillo de cuatro miembros puede abrirse para producir el primer producto alqueno nuevo R-CH=CH-R y una especie de carbeno metálico. Este carbeno metálico puede reaccionar con otra olefina reaccionante para formar otro intermedio de 4 anillos altamente teñido a través de una reacción de cicloadición 2+2. Este anillo puede entonces reabrirse nuevamente para producir el segundo producto de metátesis de alqueno, en este caso etileno, y el catalizador original. El catalizador regenerado puede entonces iniciar un nuevo ciclo catalítico.

