5.4: Compuestos organoméricos
- Page ID
- 69517
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Síntesis
Las rutas más comunes a los compuestos organoméricos implican la reacción directa del mercurio con un yoduro de alquilo (Ecuación 5.4.1) para formar el análogo de mercurio de un reactivo de Grignard.
\[\text{Hg + RX} \rightarrow \text{RHgX}\]
La reacción posterior de rhGI con cianuro de potasio produce el derivado de dialquil mercurio apropiado (Ecuación 5.4.2).
\[ \text{2 RHgI + 2 KCN} \rightarrow \text{R}_2\text{Hg + Hg + 2 KI + (NC)}_2\]
Solvomercuración
El proceso general de solvomercuración implica la adición de HgX 2 a través de un doble enlace alqueno (o triple alquino) en presencia de un disolvente. La solvomerización se aplica cuando HY, de la Ecuación 5.4.3, son parte del sistema disolvente, por ejemplo, en agua el proceso puede describirse como hidroximercuración.

La adición al alqueno ocurre con la adición de Markovnikoff, es decir, a través de la formación del ion carbonio más estable resultante con la adición de mercurio al carbono menos sustituido. El enlace Hg-C se puede escindir mediante la adición de NaBH 4 para producir el enlace C-H. Es común emplear acetato de mercurio, Hg (OAc) 2 (OAc = O 2 CCH 3), con posterior reacción con NaCl o NaI para formar el haluro, en lugar del haluro de mercurio directamente. Sin embargo, el acetato también puede actuar como un neucleófilo dando como resultado una mezcla de productos. El orden de reactividad de los alquenos sigue la tendencia:
\[ \text{R}_2\text{C=CH}_2\text{ > R(H)C=CH}_2 \text{ >} cis \text{ R(H)C=C(H)R > } trans \text{ R(H)C=C(H)R > R}_2\text{C=C(H)R > R}_2\text{C=CR}_2 \]
Esto se debe a una combinación de efectos estéricos y electrónicos. La adición ocurre de manera trans/anti.
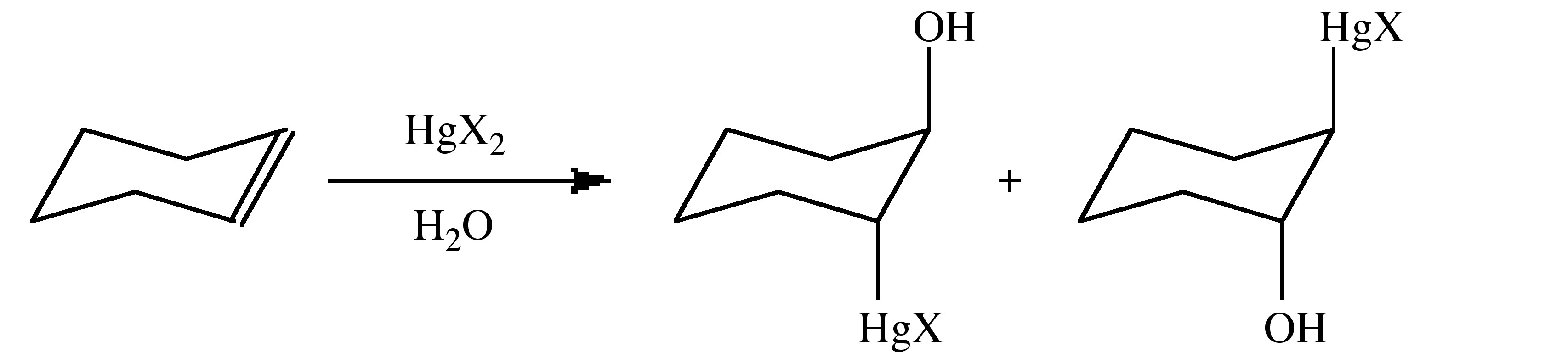
Los haluros de mercurio (II) se disocian en disolventes polares (Ecuación 5.4.4) y esta especie se asocia comúnmente con la etapa inicial de reacción.
\[ \text{HgX}_2 \leftrightharpoons \text{HgX}^+ \text{ + X}^-\]
El mecanismo de solvomercuración se describe mejor por la reacción que se muestra en.

La evidencia del mecanismo es doble:
- La adición es exclusivamente trans.
- No se observa ningún reordenamiento incluso para t Bu (H) C=C (H) t Bu cuyo ion carbonio se sabe que sufre reordenamiento.
Los estudios isotópicos indican que la formación de enlaces C-O está presente en el estado de transición. El puente de mercurio en estado de transición puede no ser simétrico, pero la estructura es similar a la adición de Br + y AUx + a los alquenos.

La reacción real se realizó originalmente con Hg (OAc) 2 en benceno a 110 °C durante varias horas en solución de ácido acético. Se encontró que la reacción fue catalizada por la presencia de HClO 4, H 2 SO 4 y HNO 3, los cuales fueron encontrados para reemplazar el ion acetato. La velocidad de reacción también se incrementa en 690,000 veces por el uso de Hg (O 2 CCF 3) 2 en HO 2 CCF 3.
La solvomercuración de alquinos da compuestos de alquenilmercurio, pero la reacción es más lenta que para la reacción con alquenos, y el producto es siempre el isómero trans.
Mercura de compuestos aromáticos
La mercura es una reacción de sustitución aromática electrófila que es posible para la mayoría de las especies de 2n+2 π-electrón. La evidencia del intermedio del complejo π se indica mediante espectroscopia UV, la cual muestra un incremento en la región 280 — 320 nm para la reacción de compuestos aromáticos con Hg (O 2 CCF 3) 2 en HO 2 CCF 3. El complejo σ-se ha detectado en SO 2 líquido.

Como método preparativo, la mercura sufre de alack selectividad, incluyendo una isomerización de para sustitución a baja temperatura a metasubstitución a altas temperaturas.
Estructura
Los compuestos de dialquilmercurio, R 2 Hg, son generalmente estables al aire y muestran poco comportamiento ácido de Lewis. Son líquidos incoloros monoméricos o sólidos de bajo punto de fusión, e.g., Bp = 92.5 °C para Me 2 Hg. No se observa solubilidad en agua, excepto para (F 3 C) 2 Hg (Ecuación 5.4.5).
\[ \text{(F}_3\text{C)}_2\text{Hg + H}_2\text{O} \leftrightharpoons \text{(F}_3\text{C)}_2\text{Hg(OH)}^- \text{ + H}^+ \]
La hibridación en mercurio involucra los orbitales 6s y 6p; sin embargo, el 5d puede estar involucrado. Las estructuras cristalinas de rayos X tanto para R 2 Hg como para rhGX muestran estructuras lineales. En general, los compuestos de R 2 Hg son ácidos de Lewis muy débiles, pero se forman aductos si el grupo alquilo es suficientemente atrayente de electrones, por ejemplo, (C 6 F 5) 2 Hg. La geometría del complejo ácido-base de Lewis no es triangular como se predice de la teoría VSEPR, sino una forma de T. La distorsión de una unidad lineal C-Hg-C es menor. Por ejemplo, en (C 6 F 5) 2 Hg el ángulo C-Hg-C es de 176.2°, mientras que en [(C 6 F 5) 2 Hg] 2 (diars), donde diars = Ph 2 ASCh 2 CH 2 AspH 2, el mismo ángulo es de 173°. Además, la distancia de enlace atomo-Hg donante (por ejemplo, As-Hg = 3.4 Å) es solo ligeramente más corta que la suma de los radios de van der Waal (por ejemplo, 3.5 Å).

Bibliografía
- L. C. Damude y P. A. W. Dean. J. Organomet. Chem. , 1979, 181, 1.
- L. C. Damude y P. A. W. Dean. J. Chem. Soc., Chem. Commun. , 1978, 1083.
- J. L. Courtneidge, A. G. Davies, P. S. Gregory, D. C. McGuchan, y S. N. Yazdi. J. Chem. Soc., Chem. Commun. , 1987, 1192.
- P. B. Hitchcock, J. M. Keates, y G. A. Lawless, J. Am. Chem. Soc. , 1998, 120, 599.


