8.1: El Grupo 15 Elementos- Los Pnictógenos
- Page ID
- 69462
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los elementos
Los elementos del Grupo 15 tienen un nombre particular pnictógenos. A pesar de la notación moderna de la IUPAC, los elementos del Grupo 15 todavía son referidos como elementos del Grupo V en particular por la industria de semiconductores. En la tabla se\(\PageIndex{1}\) enumera la derivación de los nombres de los elementos del Grupo 15.
| Element | Símbolo | Nombre |
| Nitrógeno | N | Nitrógeno latino, donde nitrum (derivado del nitrón griego) significa salitre |
| Fosforo | P | Del griego fosforos que significa portadora de luz |
| Arsénico | Como | Derivado de zarniqa siríaco y zarnikh persa, que significa orpimento amarillo |
| Antimonio | Sb | Griego anti y monos que significa no solo. El símbolo Sb del latín stibium |
| Bismuto | Bi | Nuevo bisemutum latino del alemán Wismuth, que significa masa blanca |
Nota
Según el Oxford English Dictionary, la ortografía correcta del elemento es el fósforo. La palabra fósforo es la forma adjetiva de la valencia P 3+. De la misma manera que el azufre forma compuestos sulfurosos y sulfúricos, el fósforo forma compuestos de fósforo (por ejemplo, ácido fosforoso) y compuestos fosfóricos de valencia P 5+ (por ejemplo, ácidos fosfóricos y fosfatos).
Descubrimiento
Nitrógeno
El nitrógeno fue descubierto por Rutherford (Figura\(\PageIndex{1}\)) en 1772. Lo llamó aire nocivo o aire fijo porque ahí se sabía desde finales del siglo XVIII que había una fracción de aire que no soportaba la combustión. El nitrógeno también fue estudiado por Scheele (Figura\(\PageIndex{2}\)), Cavendish (Figura\(\PageIndex{3}\)) y Priestley (Figura\(\PageIndex{4}\)), quienes lo denominaron aire quemado o aire flogisticado.




Fosforo
El alquimista alemán Hennig Brand (Figura\(\PageIndex{5}\)) estaba experimentando con orina (que contiene fosfatos disueltos) en 1669. Al intentar crear la legendaria piedra filosofal (la legendaria sustancia alquímica capaz de convertir los metales básicos, como el plomo, en oro) mediante la destilación de sales de la orina, produjo un material blanco que brillaba en la oscuridad y quemaba con una luz brillante. Le dio a la sustancia el nombre de fósforo mirabilis (portador milagroso de la luz). Su proceso consistió en dejar reposar la orina durante días y luego hervirla hasta convertirla en una pasta que condujo a una sustancia cerosa blanca, el fósforo blanco.

Brand vendió la receta de 200 thaler (una moneda de plata de cuyo nombre deriva el dólar) a D Krafft que recorrió gran parte de Europa mostrándola. Durante sus viajes conoció a Robert Boyle (Figura\(\PageIndex{6}\)) quien sin conocer los detalles de la síntesis la recreó y mejoró mediante el uso de arena en la reducción del fosfato, (8.1.1).
\[\text{4 NaPO}_3 \text{ + 2 SiO}_2\text{ + 10 C} \rightarrow \text{2 Na}_2\text{SiO}_3\text{ + 10 CO + P}_4\]

Arsénico
Los sulfuros y óxidos de arsénico se conocían desde la antigüedad. Zosimos (ca. 300 d.C.) describe asar sandarach (realgar, α-AS 4 S 4) para obtener nube de óxido arsenioso (As 2 O 3) que redujo a arsénico metálico (Figura\(\PageIndex{7}\)).

Antimonio
El sulfuro de antimonio (III), Sb 2 S 3 se conocía ya en el 3000 a.C. Las pastas de Sb 2 S 3 en polvo en grasa se utilizaron como cosméticos para los ojos en el Medio Oriente. Un artefacto hecho de antimonio que data de alrededor del 3000 a.C. fue encontrado en Tello (parte del actual Irak), y en Egipto se han encontrado objetos de cobre chapados con antimonio entre 2500 y 2200 a.C. La primera descripción europea de un procedimiento para aislar antimonio se encuentra en el libro De la pirotecnia de Vannoccio Biringuccio (1480 - 1539).
Bismuto
Dado que el bismuto era conocido en la antigüedad, a ninguna persona se le atribuye su descubrimiento. Sin embargo, el químico francés Claude François Geoffroy (1729 - 1753) demostró en 1753 que este metal es distinto del plomo y el estaño.
Abundancia
La abundancia de los elementos del Grupo 15 se da en la Tabla\(\PageIndex{2}\).
| Element | Abundancia terrestre (ppm) |
| N | 25 (corteza terrestre), 5 (suelo), 0.5 (agua de mar), 78 x 10 4 (atmósfera) |
| P | 1000 (corteza terrestre), 0.65 (suelo), 60 x 10 -3 (agua de mar), rastro (atmósfera) |
| Como | 1.5 (corteza terrestre), 10 (suelo), 16 x 10 -3 (agua de mar), rastro (atmósfera) |
| Sb | 0.2 (corteza terrestre), 1 (suelo), 0.3 x 10 -3 (agua de mar) |
| Bi | 48 x 10 -3 (corteza terrestre), 0.25 (suelo), 400 x 10 -6 (agua de mar) |
Isótopos
Los isótopos naturalmente abundantes de los elementos del Grupo 15 se enumeran en la Tabla\(\PageIndex{3}\).
| Isótopo | Abundancia natural (%) |
| Nitrógeno-14 | 99.634 |
| Nitrógeno-15 | 0.0366 |
| Fósforo-31 | 100 |
| Arsenio-75 | 100 |
| Antimonio-121 | 57.36 |
| Antimonio-123 | 42.64 |
| Bismuto-209 | 100% |
Dos isótopos radiactivos de fósforo (32 P y 33 P) tienen semividas que los hacen útiles para experimentos científicos (14.262 y 25.34 días, respectivamente). 32 P es un emisor β (1.71 MeV) y se utiliza para producir sondas de ADN y ARN radiomarcadas. Debido a la alta energía de las partículas β que pueden penetrar la piel y las córneas, y debido a que cualquier 32 P ingerido, inhalado o absorbido se incorpora en el hueso y los ácidos nucleicos, se debe tener mucho cuidado en el manejo. Las partículas β de menor energía emitidas por 33 P (0.25 MeV) lo hacen útil para aplicaciones como la secuenciación de ADN.
Si bien el bismuto se considera tradicionalmente como el elemento con el isótopo estable más pesado, 209 Bi, durante mucho tiempo se sospechaba que era inestable por razones teóricas. En 2003 investigadores del Institut d'Astrophysique Spatiale en Orsay, Francia, midieron la semivida de emisión alfa de 209 Bi para ser 1.9 × 10 19 años, ¡más de mil millones de veces más que la edad estimada actual del universo!
Producción industrial de los elementos
El nitrógeno es el constituyente más grande de la atmósfera terrestre (78.082% en volumen, 75.3% en peso). Se crea por procesos de fusión en estrellas, y se estima que es el séptimo elemento más abundante por masa en el universo. El gas industrial producido es por destilación fraccionada de aire líquido, o por medios mecánicos usando aire gaseoso (es decir, membrana de ósmosis inversa presurizada o adsorción por oscilación de presión). El nitrógeno comercial es a menudo un subproducto del procesamiento de aire para la concentración industrial de oxígeno para la fabricación de acero, etc.
El fósforo blanco se fabricó originalmente comercialmente para la industria de fósforos en el siglo XIX, al destilar vapor de fósforo de fosfatos precipitados, mezclados con carbón molido o carbón vegetal, (8.1.2). Los fosfatos precipitados se elaboraron a partir de huesos molidos que habían sido desengrasados y tratados con ácidos fuertes. Este proceso es, sin embargo, obsoleto debido a que se introdujo el horno de arco sumergido para la producción de fósforo para reducir la roca fosfórica. El fosfato de calcio (roca de fosfato) se calienta a 1200 - 1500 °C con SiO 2 y coque (carbono impuro) para producir tetrafosforo vaporizado, P 4.
\[\text{Ca}_{10}\text{(PO}_4\text{)}_6\text{F}_2\text{ + 15 C + 9 SiO}_2\rightarrow \text{6 P}_{\text{n(g)}}\text{ + 9 [(CaO.SiO}_2\text{)] + CaF}_2\text{ + 15 CO}_{\text{(g)}}\]
Propiedades físicas
Las propiedades físicas de los elementos del Grupo 15 (Tabla\(\PageIndex{3}\)) abarcan un gas (N 2), un sólido no metálico (P 4), metaloides (As y Sb) y un metal (Bi).
| Element | Mp (°C) | Bp (°C) | Densidad (g/cm 3) |
| N | -210.00 | -195.79 | 1.251 g/L (0 °C @ 101.325 kPa) |
| P | 44.2 (blanco), 610 (negro) | 280.5 (blanco), 416 - 590 (sub., rojo), 620 (sub, violeta) | 1.823 (blanco), 2.2 - 2.34 (rojo), 2.36 (violeta), 2.69 (negro) |
| Como | 817 | 615 (sub.) | 5.727 |
| Sb | 630.63 | 1587 | 6.697 (sólido), 6.53 (líquido) |
| Bi | 271.5 | 1564 | 9.78 (sólido), 10.05 (líquido) |
Fase de vapor
El nitrógeno forma un dímero en fase vapor con un triple enlace (Figura\(\PageIndex{8}\)). En la fase vapor por encima de 800 °C, el tetraposforo (P 4) se disocia parcialmente a P 2.

Estado sólido
El fósforo forma una serie de alótropos con propiedades muy diferentes (Figura\(\PageIndex{9}\)). El fósforo rojo es una fase intermedia entre las formas blanca y violeta. El fósforo escarlata se obtiene al permitir que una solución de fósforo blanco en disulfuro de carbono se evapore a la luz solar. El fósforo negro se forma calentando fósforo blanco a altas presiones (ca. 12,000 atmósferas).

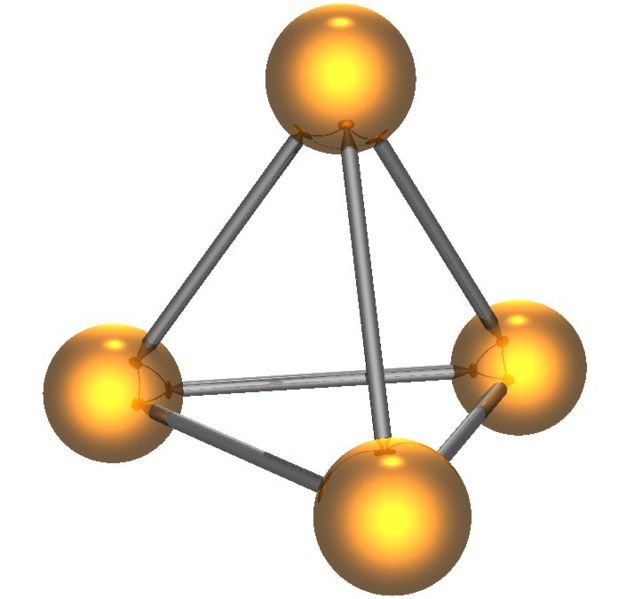
El fósforo blanco tiene dos formas, la forma β de baja temperatura y la forma α de alta temperatura; ambas contienen el tetraedro P4 (Figura\(\PageIndex{10}\)). El fósforo blanco es el menos estable, el más reactivo, el más volátil, menos denso y el más tóxico de los alótropos.
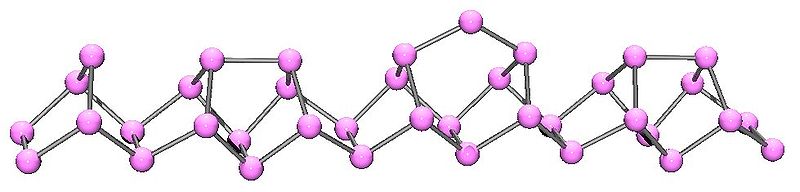
La relación estructural entre fósforo blanco y rojo implica romper uno de los enlaces P-P en la unidad P 4 y formar un enlace con un tetraedro vecino para dar una estructura de cadena (Figura\(\PageIndex{11}\)). El fósforo rojo se forma calentando el fósforo blanco a 250 °C o exponiendo el fósforo blanco a la luz solar. En realidad, el fósforo rojo no es un solo alótropo, sino una fase intermedia entre el fósforo blanco y violeta, y la mayoría de sus propiedades tienen un rango de valores (Tabla\(\PageIndex{3}\)).

El fósforo violeta (Figura\(\PageIndex{12}\)) es la forma termodinámica estable del fósforo que se produce calentando el fósforo rojo por encima de 550 °C; debido a la síntesis que desarrolla Johann Hittorf (Figura\(\PageIndex{13}\)), a veces se le conoce como fósforo de Hittorf.

El fósforo negro es el alótropo menos reactivo y la forma termodinámica estable por debajo de 550 °C, también se le conoce como fósforo β-metálico y tiene una estructura algo parecida a la del grafito (Figura\(\PageIndex{14}\)).

De manera similar al fósforo, el arsénico tiene varios alótropos algunos de los cuales están estructuralmente relacionados con los del fósforo. El arsénico gris tiene una estructura similar al fósforo negro (Figura\(\PageIndex{10}\)). El arsénico amarillo (As 4) es blando y ceroso con una estructura similar a demasiado P 4 (Figura\(\PageIndex{14}\)). Finalmente, el arsénico negro es similar en estructura al fósforo rojo (Figura\(\PageIndex{11}\)). El antimonio y el bismuto son metales tradicionales y tienen estructuras trigonales hexagonales (a = 4.299, c = 11.25 Å, y a = 4.537, c = 11.838 Å, respectivamente).
Bibliografía
- V. Biringuccio, La pirotecnia de Vannoccio Biringuccio: El tratado clásico del siglo XVI sobre metales y metalurgia, Publicaciones de Dover (1990).


