11.1: El Grupo 18 Elementos- Los Gases Noble
- Page ID
- 69549
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los elementos
Los elementos del Grupo 18 tienen un nombre particular Gases nobles. El gas noble se traduce del sustantivo alemán Edelgas, utilizado por primera vez en 1898 por Hugo Erdmann (1862 - 1910) para indicar su extremadamente bajo nivel de reactividad. A los gases nobles a menudo también se les llamaba los gases inertes, sin embargo, dado que ahora se conocen compuestos de gases nobles este nombre ya no se usa. Tabla\(\PageIndex{1}\) enumera la derivación de los nombres de los gases Noble.
| Element | Símbolo | Nombre |
| Helio | Él | Helios griego que significa el Sol |
| Neón | Ne | Del griego que significa uno nuevo |
| Argón | Ar | Del griego que significa inactivo |
| Krypton | Kr | Del griego kryptos que significa el oculto |
| Xenon | Xe | Del griego xenos], que significa extranjero, extraño o invitado |
| Radón | Rn | De su naturaleza radiactiva |
Descubrimiento
Helio
La primera evidencia de helio fue la observación del astrónomo Pierre Janssen (Figura\(\PageIndex{1}\)) el 18 de agosto de 1868 como una línea amarilla brillante con una longitud de onda de 587.49 nm en el espectro de la cromosfera del Sol. El 20 de octubre del mismo año, el astrónomo inglés Norman Lockyer (Figura\(\PageIndex{2}\)) observó una línea amarilla en el espectro solar, a la que llamó la línea D3 Fraunhofer porque estaba cerca de las conocidas líneas D1 y D2 de sodio. Concluyó que fue causado por un elemento en el Sol desconocido en la Tierra. Lockyer y Edward Frankland (Figura\(\PageIndex{3}\)) nombraron al elemento con la palabra griega para el Sol, helios.



El 26 de marzo de 1895 el químico británico Sir William Ramsay (Figura\(\PageIndex{4}\)) aisló helio en la Tierra tratando el mineral cleveita (un mineral radiactivo que contiene uranio y que se encuentra en Noruega) con ácidos minerales.

Neón
Neón fue descubierto en 1898 por Sir William Ramsay (Figura\(\PageIndex{4}\)) y Morris Travers (Figura\(\PageIndex{5}\)). Cuando Ramsay enfrió una muestra de aire hasta que se convirtió en líquido, luego calentó el líquido y capturó los gases a medida que hierven. Después de nitrógeno, oxígeno y argón, los tres gases que se desprendieron fueron el kriptón, el xenón y el neón.

Argón
En 1785 Henry Cavendish (Figura\(\PageIndex{6}\)) sospechaba que el argón estaba presente en el aire pero no fue aislado hasta 1894 por Lord Rayleigh (Figura\(\PageIndex{7}\)) y Sir William Ramsay (Figura\(\PageIndex{4}\)) en un experimento en el que eliminaron todo el oxígeno, dióxido de carbono, agua y nitrógeno de una muestra de aire limpio.

Krypton
Krypton fue descubierto en 1898 por Sir William Ramsay (Figura\(\PageIndex{4}\)) y Morris Travers (Figura\(\PageIndex{5}\)) en el residuo dejado por la evaporación de casi todos los componentes del aire líquido.
Nota
En 1960, un acuerdo internacional definió el metro (m) en términos de longitud de onda de luz emitida por el isótopo 86 Kr (longitud de onda de 605.78 nm). Este acuerdo reemplazó al medidor estándar ubicado en París, que era una barra metálica hecha de una aleación de Pt-Ir, y en sí mismo fue reemplazado por una definición basada en la velocidad de la luz, una constante física fundamental. En octubre de 1983, el Bureau International des Poids et Mesures definió el medidor como la distancia que recorre la luz en vacío durante 1/299,792,458 s.
Xenon
El xenón fue descubierto por William Ramsay (Figura\(\PageIndex{4}\)) y Morris Travers (Figura\(\PageIndex{5}\)) el 12 de julio de 1898, poco después de su descubrimiento de criptón y neón.
Radón
El radón fue el quinto elemento radiactivo que se descubrió después del uranio, torio, radio y polonio. Descubierto en 1900 por Friedrich Dorn (Figura\(\PageIndex{8}\)) después de que notó que los compuestos de radio emanan un gas radiactivo al que denominó Emanación de radio (Ra Em). Previo a estos experimentos, en 1899, Pierre y Marie Curie (Figura\(\PageIndex{9}\)) observaron que el gas emitido por el radio permaneció radiactivo durante un mes. Posteriormente ese año, Ernest Rutherford (Figura\(\PageIndex{10}\)) notó variaciones al intentar medir la radiación del óxido de torio. En 1901, demostró que las emanaciones son radiactivas, pero acreditó a los Curies por el descubrimiento del elemento.



Abundancia
La abundancia de los gases nobles se da en la Tabla\(\PageIndex{2}\).
| Element | Abundancia terrestre (ppm) |
| Él | 8 x 10 -3 (corteza terrestre), 4 x 10 6 (agua de mar), 5 (atmósfera) |
| Ne | 70 x 10 -3 (corteza terrestre), 0.2 (agua de mar), 18 (atmósfera) |
| Ar | 1.2 (corteza terrestre), 0.45 (agua de mar), 0.93 x 10 4 (atmósfera) |
| Kr | 10 x 10 -6 (corteza terrestre), 80 x 10 -6 (agua de mar), 1 (atmósfera) |
| Xe | 2 x 10 -6 (corteza terrestre), 100 x 10 -6 (agua de mar), 90 x 10 -3 (atmósfera) |
Isótopos
Los isótopos naturalmente abundantes de los elementos del Grupo 18 se enumeran en la Tabla\(\PageIndex{3}\). Todos los isótopos del radón son radiactivos.
| Isótopo | Abundancia natural (%) |
| Helio-3 | 0.000137 |
| Helio-4 | 99.999863 |
| Neón-20 | 90.48 |
| Neón-21 | 0.27 |
| Neón-22 | 9.25 |
| Argón-36 | 0.337 |
| Argón-86 | 0.063 |
| Argón-40 | 99.600 |
| Krypton-78 | 0.35 |
| Krypton-80 | 2.25 |
| Krypton-81 | rastro |
| Krypton-82 | 11.6 |
| Krypton-83 | 11.5 |
| Krypton-84 | 57 |
| Krypton-86 | 17.3 |
| Xenón-124 | 0.095 |
| Xenón-126 | 0.089 |
| Xenón-128 | 1.91 |
| Xenón-129 | 26.4 |
| Xenón-130 | 4.07 |
| Xenón-131 | 21.2 |
| Xenón-132 | 26.9 |
| Xenón-134 | 10.4 |
| Xenón-136 | 8.86 |
| Radón-222 | rastro |
A diferencia de la mayoría de los elementos, la abundancia isotópica del helio varía mucho según el origen, debido a los diferentes procesos de formación. El isótopo más común, 4 He, es producido en la Tierra por una desintegración de elementos radiactivos más pesados. También se formó en enormes cantidades durante el Big Bang.
40 K de origen natural con una vida media de 1.25 × 10 9 años, decae a 40 Ar estable (11.2%) por captura de electrones y emisión de positrones, y también a 40 Ca estable (88.8%) vía desintegración beta. Estas propiedades y proporciones se utilizan para determinar la edad de las rocas.
Con una vida media de 230.000 años 81 Kr se utiliza para fechar aguas subterráneas de 50,000 a 800,000 años de antigüedad. 85 Kr es un gas noble radiactivo inerte con una vida media de 10.76 años. Se produce en pruebas de bombas nucleares y reactores nucleares. Se liberan 85 Kr durante el reprocesamiento de barras de combustible de reactores nucleares.
Producción industrial de los elementos
El helio se extrae por destilación fraccionada del gas natural, que contiene hasta 7% de helio. Dado que el helio tiene un punto de ebullición más bajo que cualquier otro elemento, se utilizan baja temperatura y alta presión para licuar casi todos los demás gases. El gas helio resultante se purifica mediante exposiciones sucesivas a temperaturas decrecientes. Una etapa de purificación final con carbón activado da como resultado helio de grado A 99.995% puro.
El argón se produce industrialmente por la destilación fraccionada de aire líquido, proceso que separa el nitrógeno líquido, que hierve a 77.3 K, del argón, que hierve a 87.3 K y el oxígeno, que hierve a 90.2 K. El xenón se obtiene comercialmente como subproducto de la separación del aire en oxígeno y nitrógeno.
Propiedades físicas
Las propiedades físicas de los elementos del Grupo 18 se dan en la Tabla\(\PageIndex{4}\).
| Element | Mp (°C) | Bp (°C) |
| Él | -272.20 | -268.93 |
| Ne | -248.59 | -246.08 |
| Ar | -189.35 | -185.85 |
| Kr | -157.36 | -153.22 |
| Xe | -111.7 | -108.12 |
| Rn | -71.15 | -61.85 |
Todos los gases nobles muestran líneas espectrales características (Figura\(\PageIndex{11}\) — Figura\(\PageIndex{15}\)).





Compuestos de los elementos del Grupo 18.
Sólo se han formado unos pocos cientos de compuestos de gas noble. No se han formado compuestos neutros de helio y neón, mientras que el xenón, el criptón y el argón han mostrado una reactividad menor. La reactividad sigue el orden:

Los compuestos de xenón son los más numerosos de los compuestos de gas noble. Estados de oxidación de +2, +4, +6 y +8 con elementos electronegativos, por ejemplo, xEF 2, xEF 4, xEF 6, xEo 4 y Na 4 xEo 6. También se han observado compuestos de xenón unidos a boro, hidrógeno, bromo, yodo, berilio, azufre, titanio, cobre y plata, pero solo a bajas temperaturas en matrices de gases nobles, o en chorros supersónicos de gas noble.
Aunque el radón es más reactivo que el xenón, debería formar enlaces químicos más fácilmente que el xenón, sin embargo, debido a la alta radiactividad y corta vida media de los isótopos de radón, solo se han formado unos pocos fluoruros y óxidos de radón.
El kriptón es menos reactivo que el xenón, y los estados de oxidación generalmente se limitan a +2, kRf 2. Los compuestos en los que el criptón forma un enlace con nitrógeno y oxígeno solo son estables por debajo de -60 °C y -90 °C, respectivamente. Átomos de criptón unidos químicamente a otros no metales (hidrógeno, cloro, carbono) así como a algunos metales de transición tardía (cobre, plata, oro), pero solo a bajas temperaturas en matrices de gases nobles, o en chorros supersónicos de gas noble. Se utilizaron condiciones similares para obtener los primeros compuestos de argón.
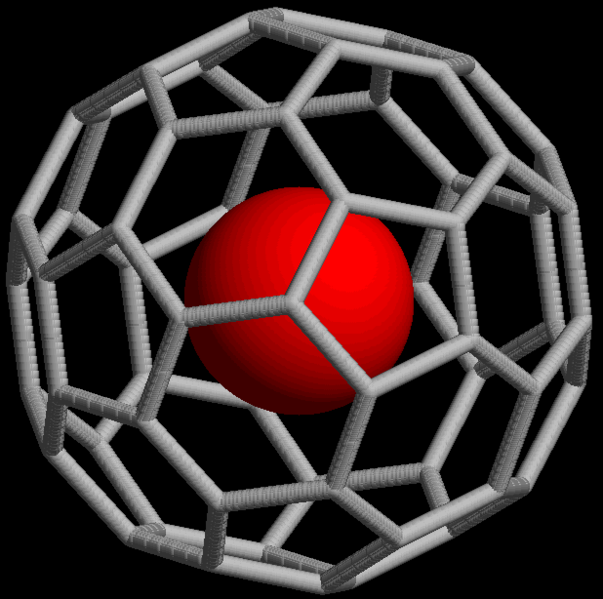
Los gases nobles también forman compuestos no covalentes, por ejemplo clatratos que consisten en un átomo atrapado dentro de cavidades de redes cristalinas de compuestos orgánicos e inorgánicos. Los gases nobles pueden formar compuestos endoédricos de fullereno, en los que el átomo de gas noble queda atrapado dentro de una molécula de fullereno (Figura\(\PageIndex{16}\)).
Bibliografía
- L. Pauling, J. Am. Chem. Soc. , 1933, 55, 1895.
- M. Saunders, H. A. Jiménez-Vázquez, R. J. Cross, y R. J. Poreda, Ciencia, 1993, 259, 1428.


