3.1: Unión en compuestos
- Page ID
- 77219
Enlaces químicos
Los compuestos son una forma pura de materia formada por átomos de más de un elemento combinados en una relación constante en número entero.
Los enlaces conectan los átomos en los compuestos. Compartir o transferir algunos electrones de cenefa de un átomo al otro hace los enlaces. Los gases nobles tienen una capa de valencia completa de ocho electrones de valencia, excepto helio que tiene una capa de valencia completa de dos electrones de valencia. Los gases nobles son los menos reactivos, es decir, el grupo de elementos más inertes.
La regla del octeto establece que los átomos de todos los elementos distintos de los gases nobles tienden a compartir, perder o ganar electrones de valencia para adquirir la configuración electrónica del gas noble más cercano que tiene ocho electrones de valencia.
Enlaces covalentes
Un enlace formado al compartir electrones es un enlace covalente.
Cuando un átomo no metálico se combina con otro átomo no metálico, suelen formar un enlace covalente. Un enlace covalente es un par de electrones compartidos, llamados pares de electrones de unión, donde cada átomo unido aporta un electrón. Por ejemplo, el cloro tiene siete electrones de valencia y necesita uno más para completar su octeto. El hidrógeno tiene un electrón de valencia y requiere uno más para adquirir la configuración electrónica del helio, es decir, dueto en lugar del octeto. El hidrógeno y el cloro se combinan compartiendo un electrón para hacer el compuesto HCl. De manera similar, el oxígeno, el nitrógeno y el carbono forman 2, 3 y 4 enlaces covalentes con hidrógeno para completar su octeto y formar los compuestos H 2 O, NH 3 y CH 4, respectivamente, como se ilustra en la Fig. 3.1.1.
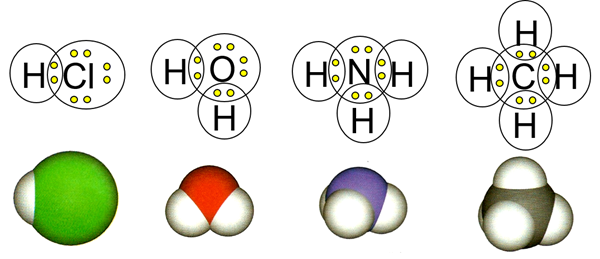
Dos átomos pueden compartir uno, dos o tres electrones para formar un enlace covalente simple, doble o triple. Por ejemplo, H 2 tiene un enlace sencillo (H-H), O 2 tiene un doble enlace (O=O), y N 2 tiene un triple enlace (N=N), donde cada línea entre los átomos representa un enlace covalente. La Fig. 3.1.2 ilustra la formación de tres enlaces covalentes en N2. Un par de electrones de valencia que no está involucrado en la unión se llama par no enlazante. Un par no enlazante y tres pares de enlaces completan el octeto de cada átomo de nitrógeno en la molécula N 2, como se muestra en la Fig. 3.1.2.
El par de electrones de enlace cuenta hacia el total de electrones de valencia de cada átomo unido., es decir, en H-H cada átomo de hidrógeno tiene dos electrones de valencia, y en: N=N: cada nitrógeno tiene ocho electrones de valencia; dos en el par no enlazante y seis en tres pares de enlace.

La fórmula de un compuesto covalente
Un compuesto está representado por una fórmula química que combina los símbolos de sus elementos constituyentes. Generalmente se escriben primero más elementos electropositivos, por ejemplo, HF, NO, CO. Algunas excepciones a esta regla, por ejemplo, NH 3 y CH 4, tienen más elementos electronegativos escritos primero. La mayoría de los compuestos covalentes existen como moléculas discretas. Un subíndice a la derecha del símbolo del elemento representa el número de átomos del componente de la molécula. Por ejemplo, H 2 O tiene dos átomos de hidrógeno y un átomo de oxígeno en una molécula de agua. Obsérvese que el subíndice 1 no está escrito, es decir, el símbolo de un elemento solo representa un átomo.
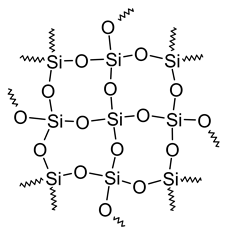
Algunos compuestos unidos covalentemente son moléculas gigantes donde los átomos se mantienen unidos por una red 3D de enlaces. La fórmula de estos compuestos muestra la relación de número entero más simple de elementos en el compuesto. Por ejemplo, la Fig. 3.1.3 muestra SiO 2 presente en arena y cuarzo de alta pureza, una molécula gigante.

Enlace iónico
Un enlace formado por la transferencia de electrones de un átomo a los otros átomos es un enlace iónico.
Un compuesto que tiene enlaces iónicos es un compuesto iónico. Por lo general, los átomos metálicos pierden electrones y se convierten en cationes, y los átomos no metálicos ganan electrones para convertirse en aniones. La atracción electrostática entre las cargas opuestas mantiene los iones juntos en el compuesto iónico. Por ejemplo, el sodio (Na) pierde un electrón, y el flúor (F) gana un electrón para hacer un compuesto fluoruro de sodio (NaF), como se ilustra en la Fig. 3.1.4.
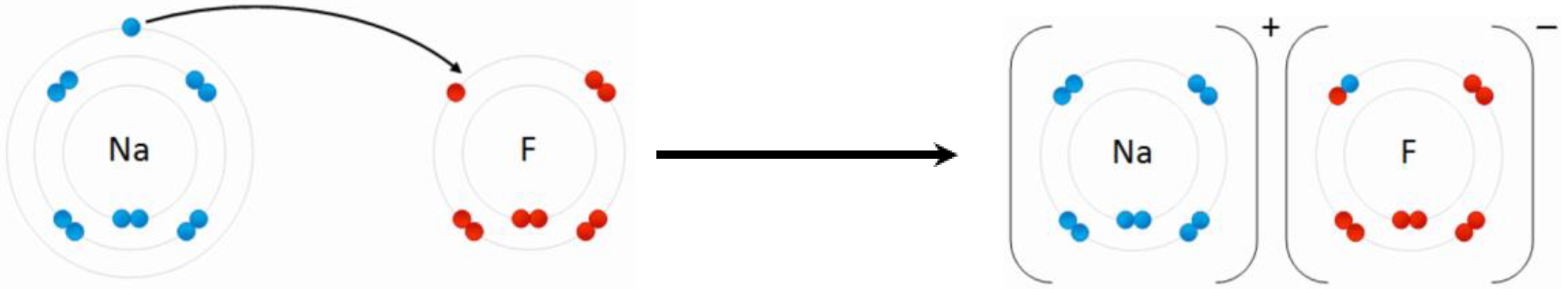
Compuestos iónicos
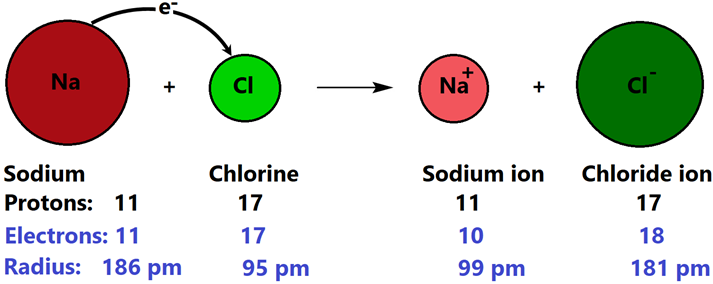
La sal de mesa, es decir, NaCl es un ejemplo de un compuesto iónico. El Na completa su octeto perdiendo un electrón y convirtiéndose en catión Na +. La pérdida de electrones reduce la repulsión electrón-electrón, pero la atracción electrón-núcleo sigue siendo la misma. En consecuencia, la nube de electrones alrededor del núcleo se contrae. De igual manera, el átomo de cloro tiene siete electrones de valencia. Después de ganar un electrón, se convierte en anión Cl - con su octeto completo. Ganar electrones aumenta la repulsión electrón-electrón, pero la atracción electrón-núcleo sigue siendo la misma. En consecuencia, la nube de electrones alrededor del núcleo se expande. La Fig. 3.1.5 ilustra la formación de un enlace iónico y los cambios acompañantes en el número total de electrones y tamaños con respecto a los átomos neutros progenitores en el caso de la formación de NaCl.
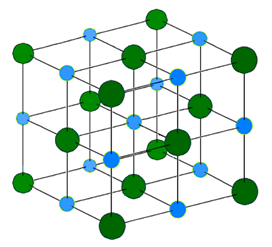
El enlace iónico no es localizado ni unidireccional. La fuerza electrostática está alrededor de los iones. Por lo tanto, los cationes rodean los aniones, y el anión rodea a los cationes en una matriz regular en una red cristalina 3D. La Fig. 3.1.6 ilustra la estructura del NaCl.
- La fórmula de los compuestos iónicos representa la relación de número entero más simple de los átomos de los elementos constituyentes.
- Un catión es siempre más pequeño en tamaño que su átomo neutro parental.
- Un anión es siempre mayor que su átomo neutro parental.


Por lo general, un enlace metálico y uno no metálico es iónico, y el enlace entre dos no metales es covalente. Los mejores criterios se basan en la diferencia de electronegatividades de los átomos unidos. La electronegatividad es la capacidad de un átomo para atraer a sí mismo un par de electrones unidos. Si la diferencia de electronegatividad es significativa, los electrones de unión se transfieren completamente al átomo más electronegativo, y el enlace es iónico. No existe un valor único de diferencia de electronegatividad para separar los enlaces iónicos y covalentes, pero generalmente, la diferencia de electronegatividad de más de 1.8 da como resultado un enlace iónico. De lo contrario, un enlace covalente, pero los electrones de unión están más hacia el átomo más electronegativo, convirtiéndolo en un enlace covalente polar. Una diferencia de electronegatividad menor a 0.5 se considera un enlace no covalente, pero se forma un verdadero enlace no covalente cuando los átomos unidos son el mismo elemento.
Propiedades de los compuestos
Las propiedades de los compuestos suelen ser completamente diferentes de las propiedades de sus elementos constituyentes. Por ejemplo, el hidrógeno (H 2) es un gas que quema en oxígeno, el oxígeno (O 2) es un gas que ayuda a la combustión, pero el agua (H 2 O) es un líquido que extingue el fuego. De igual manera, el sodio (Na) es un metal blando que se funde a 97.79 o C, el cloro (Cl 2) es gas de color amarillento, pero el cloruro de sodio (NaCl) es un cristal transparente que se funde a 801 o C.
Las interacciones intermoleculares en moléculas covalentes son débiles a moderadas en relación con la fuerza de los enlaces covalentes o enlaces iónicos. Por lo tanto, las moléculas covalentes suelen ser gases como O 2, NH 3, CH 4, líquidos como H 2 O, o sólidos blandos y de bajo punto de fusión como ceras, glucosa (C 6 H 12 O 6, mp 146 o C).
Los iones en los compuestos iónicos se mantienen unidos por fuertes enlaces iónicos en una matriz 3D de celosías cristalinas. Por lo tanto, los compuestos iónicos suelen ser sólidos duros con altos puntos de fusión. Por ejemplo, el NaCl se funde a 801 o C. Los compuestos covalentes que existen como una red 3D de enlaces covalentes, es decir, como moléculas gigantes, suelen ser materiales duros que tienen un punto de fusión más alto que los compuestos iónicos. Por ejemplo, SiO 2 presente en la arena y el cuarzo es un sólido duro que se funde a 1,710 o C. El diamante —la sustancia más dura conocida, es una molécula gigante de átomos de carbono unidos en una red 3D de enlaces covalentes que funde alrededor de 4.027 o C.


