3.2: Nombrar compuestos iónicos binarios
- Page ID
- 77224
Los compuestos iónicos binarios son compuestos compuestos por cationes monoatómicos y aniones monoatómicos. Por ejemplo, NaCl es un compuesto iónico binario compuesto por cationes monoatómicos Na + y aniones monoatómicos Cl -. Otro ejemplo es CaCl 2 compuesto por cationes monoatómicos Ca 2 + y aniones monoatómicos Cl -.
Carga en iones monoatómicos
Los no metales y metaloides del grupo 14 al grupo 17 suelen formar aniones monoatómicos. La carga sobre los aniones es igual al número de grupo menos dieciocho. Por ejemplo, los halógenos del grupo 17 tienen carga: 17-18 = -1, el oxígeno en el grupo 16 tiene carga: 16-18 = -2, y el nitrógeno en el grupo 15 tiene carga: 15-18 = -3. Los metales suelen formar cationes: los metales del grupo 1 desde +1, los metales del grupo 2 forman +2, y el aluminio del grupo 13 forman +3 cargan sobre los cationes, como se muestra en la Fig. 3.2.1. Otros metales tienen cargas variables en compuestos. La carga de los metales que tienen carga variable se puede calcular a partir de la fórmula química del compuesto porque la carga —ve total debe ser igual a la carga total +ve para hacer que el compuesto sea neutro.
calcular la carga de ion hierro en FeCl 2?
Solución
Tres son dos aniones cloruro, cada uno con una carga -1, haciendo un total de -2. Entonces la carga en catión tiene que ser +2 para equilibrar la carga negativa. Respuesta: Fe 2 +.
Calcular la carga sobre un ion hierro en Fe 2 O 3?
Solución
Hay tres aniones de oxígeno, cada uno con una carga -2, haciendo -6. Entonces la carga total en dos átomos de hierro debe ser +6, es decir, la carga en los átomos de hierro es +3. Respuesta: Fe 3 +.
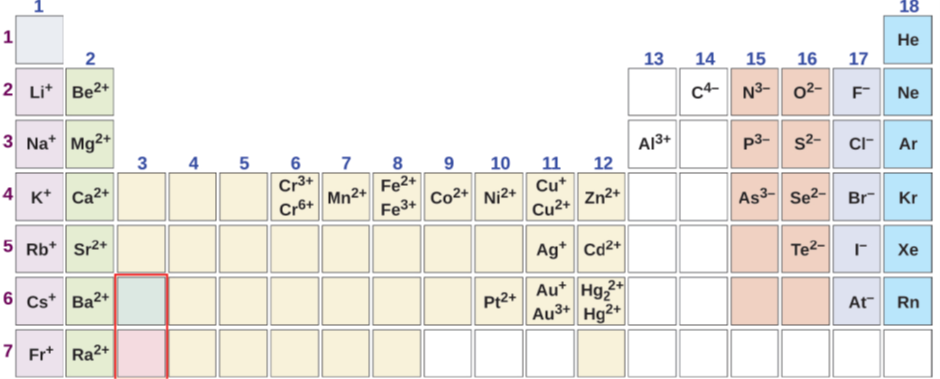
Nombres de iones monoatómicos
Nombre de un anión monoatómico
El nombre de un anión monoatómico es el nombre del elemento con la última sílaba reemplazada por —ide ion. Por ejemplo, Cl - es un ion cloruro, O 2- es un ion óxido, N 3- es un ion nitruro, S2- es ion sulfuro, y C 4- es un ion carburo, derivado de los nombres de elementos cloro, oxígeno, nitrógeno, azufre y carbono, respectivamente.
Nombre de un catión monoatómico que tiene una carga fija
Los metales alcalinos tienen +1, los metales alcalinotérreos tienen +2 y el aluminio tiene +3 de carga. Su nombre es el nombre del elemento que termina con ion. Por ejemplo, Na + es un ion sodio, Ca 2 + es un ion calcio y Al 3 + es un ion aluminio.
Nombre de un catión monoatómico que tiene una carga variable
Los nombres de los cationes que tienen una carga variable es el nombre del elemento seguido de carga en número romano encerrado en pequeñas brácteas y terminando con ion. Por ejemplo, Fe 2 + es un ion hierro (II), y Fe 3 + es un ion hierro (III), Cu + es un ion cobre (I) y Cu 2 + es un ion cobre (II).
Los iones que son importantes en los fluidos corporales incluyen el ion sodio (Na +), el ion potasio (K +), el ion calcio (Ca 2 +), el ion magnesio (Mg 2 +) y el ion cloruro (Cl -), como se muestra en la Fig. 3.2.2. Na + está presente en los fluidos dentro de las células. Regula y controla los fluidos corporales. K + está presente en fluidos fuera de las células y regula los fluidos corporales y las funciones celulares. Ca 2 + y Ma 2 + están presentes en los fluidos corporales fuera de las células, donde Ca 2 + es necesario para la contracción muscular, Mg 2 + es necesario para la contracción muscular, control nervioso y enzimas. Cl - está presente principalmente para equilibrar la carga de los cationes en los fluidos corporales.
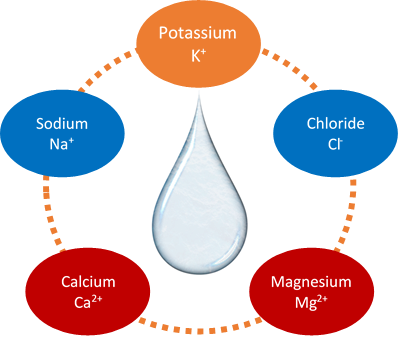
Escribir la fórmula de compuestos iónicos binarios
La fórmula de un compuesto iónico es el símbolo del elemento catiónico con un número subíndice seguido del símbolo del elemento anión con un número subíndice. La fórmula muestra la relación de número entero más simple de los elementos constituyentes en los subíndices, de tal manera que la carga positiva total es igual a la carga negativa total.script a la derecha de los símbolos indica el número si son más de un átomo del elemento.
Las reglas se ilustran en la Fig. 3.2.3:
- Escribir catión seguido de anión con cargas,
- intercambiar la carga como un subíndice del ion opuesto,
- simplificar el subíndice a la relación de número entero más simple,
- utilizar el subíndice simplificado en la fórmula final, y
- no escribas el subíndice si es uno.
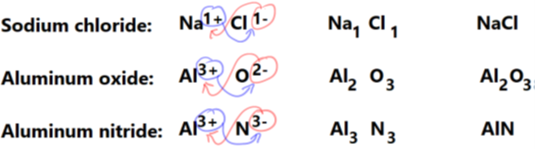
Escribir los nombres de un compuesto iónico a partir de la fórmula
Escribir el nombre de compuestos iónicos de cationes con carga fija
Si el catión tiene una carga fija en compuestos, el nombre comienza con el nombre del elemento del catión, seguido del nombre del anión sin el ión mundial al final. Por ejemplo, KI es yoduro de potasio, y CaCl 2 es cloruro de calcio.
Escribir el nombre de compuestos iónicos de cationes con carga variable
Escriba el nombre del catión, incluyendo la carga en números romanos encerrados entre corchetes pequeños pero sin la palabra ion al final, seguido del nombre del anión, sin ion al final. Por ejemplo, FeCl 2 es cloruro de hierro (II) y Fe 2 O 3 es óxido de hierro (III). En la Tabla 1 se dan ejemplos adicionales.
Los cationes de plata, zinc y cadmio tienen cambios fijos: Ag +, Zn 2 + y Cd 2 +. Los nombres de estos cationes son los nombres del elemento con o sin cargo que se muestran en números romanos, en ambos sentidos es correcto.
|
Ejemplo# |
Fórmula |
Nombre del catión |
Nombre del anión |
Nombre del compuesto |
|---|---|---|---|---|
|
1 |
NaCl |
Ion Sodio |
Ión cloruro |
Cloruro de sodio |
|
2 |
Al 2 O 3 |
Ion de aluminio |
Ión óxido |
Óxido de aluminio |
|
3 |
FeCl 3 |
Ion de hierro (III) |
Ión cloruro |
Cloruro de hierro (III) |
|
4 |
CuO |
Ion de cobre (II) |
Ión óxido |
Óxido de cobre (II) |
|
5 |
AgCl |
Ion de plata (I), o Ion de plata |
Ión cloruro |
Cloruro de plata (I), o Cloruro de Plata |


