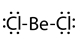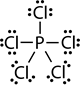3.6: Estructuras de Lewis de moléculas
- Page ID
- 77203
Lewis, símbolos, de, elementos
El símbolo de Lewis del elemento muestra el símbolo del elemento con electrones de valencia mostrados como puntos colocados en los lados superior, inferior, izquierdo y derecho del símbolo. Los electrones de valencia de hasta cuatro se muestran como un solo punto a cada lado del símbolo. Los puntos electrónicos de valencia 5ª, 6ª, 7ª y 8ª están emparejados con cualquiera de los primeros cuatro puntos. Por ejemplo, representan hidrógeno, berilio, boro, carbono, nitrógeno, flúor y neón con 1, 2, 3, 4, 5, 6, 7 y 10 electrones de valencia, respectivamente. Los símbolos de Lewis de los primeros veinte elementos se muestran en la sección 2.6, Cuadro 1.
representan hidrógeno, berilio, boro, carbono, nitrógeno, flúor y neón con 1, 2, 3, 4, 5, 6, 7 y 10 electrones de valencia, respectivamente. Los símbolos de Lewis de los primeros veinte elementos se muestran en la sección 2.6, Cuadro 1.
Estructuras de Lewis de moléculas simples
Un punto desapareado en el símbolo de Lewis de un elemento puede hacer un enlace compartiéndolo con un punto desapareado de otro átomo. El par de puntos compartidos representa un par de electrones de unión, un enlace covalente. Por ejemplo, como se muestra a continuación, un átomo de hidrógeno tiene un electrón de valencia desapareado y forma un enlace covalente con otro átomo de hidrógeno.
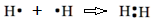
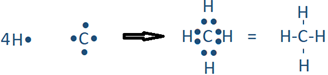
El enlace covalente se representa usualmente por una sola línea entre los átomos unidos, por ejemplo, la molécula H2 mostrada en la ecuación anterior se muestra generalmente como H-H. Un ejemplo es una reacción entre hidrógeno que tiene un electrón de valencia y carbono que tiene cuatro electrones de valencia reaccionan para formar la molécula CH 4.
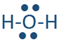
De manera similar, el hidrógeno reacciona con nitrógeno, oxígeno y flúor para formar las siguientes moléculas: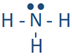 ,
, , y
, y . Cada línea en estas moléculas representa un par de electrones de enlace, y el par de puntos representa electrones de valencia que no están involucrados en la unión, llamados pares solitarios de electrones. El par solitario suele omitirse de la estructura de Lewis a menos que sea necesario enfatizar su presencia por alguna razón.
. Cada línea en estas moléculas representa un par de electrones de enlace, y el par de puntos representa electrones de valencia que no están involucrados en la unión, llamados pares solitarios de electrones. El par solitario suele omitirse de la estructura de Lewis a menos que sea necesario enfatizar su presencia por alguna razón.
Procedimiento para escribir estructuras de Lewis de moléculas
Un enfoque sistemático para escribir la estructura de Lewis de las moléculas se explica con la ayuda del siguiente ejemplo.
Dibujar las estructuras de Lewis de CH 4, PCl 3, CO 2 y HCN
Solución
Paso 1: Añadir los electrones de valencia de todos los átomos de las moléculas:
- CH 4 tiene 4 electrones de valencia en C, y 1 en cada uno de los cuatro H: = 4 + 1x4 = 8 electrones de valencia
- PCl 3 tiene 5 electros de valencia en P y 7 en cada uno de los tres Cl: = 5 + 7x3 = 26 electrones de valencia
- CO 2 tiene 4 electrones de valencia en C y 6 en cada uno de los dos O: = 4 + 6x2 = 16 electrones de valencia
- El HCN tiene 1 electrón de valencia en H, 4 en C y 5 en N: = 1 + 4 + 5 = 10 electrones de valencia
Paso 2: Coloca el símbolo del elemento con más cenefas, es decir, teniendo más puntos desapareados en su estructura de Lewis, en el centro y el resto de los átomos en cuatro lados:
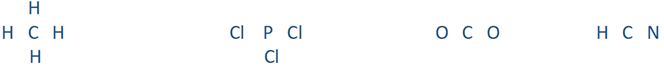
Paso 3: Dibuja una línea entre el átomo externo y el átomo central para representar un enlace covalente sencillo:

Paso 4: Cada enlace sencillo consume dos electrones de valencia. Restar el número total de electrones de valencia consumidos en todos los enlaces de los electrones de valencia totales inicialmente presentes en el paso 1:
- CH 4: 4 enlaces = 8 electrones consumidos. 8 — 8 = 0 electrones restantes
- PCl 3: enlace 3 = 6 electrones consumidos. 26 — 6 = quedan 20 electrones
- CO 2: 2 enlaces = 4 electrones consumidos. 16 — 4 = quedan 12 electrones
- HCN: 2 enlaces = 4 electrones consumidos. Quedan 10 — 4 = 6 electrones
Paso 5: Distribuir los electrones restantes como pares solitarios, primero a los átomos externos para completar su octeto (dúo en el caso del hidrógeno) y luego al átomo central para completar su octeto

Paso 6: Comprobar que el octeto de cada átomo esté completo (dúo para hidrógeno). En caso afirmativo, la estructura de Lewis es completa, por ejemplo, como en los casos de CH 4 y PCl 3 en los presentes ejemplos. De no ser así, mover uno de los pares solitarios de electrones de un átomo vecino para hacer un doble enlace, como lo muestran las flechas de color rojo en la figura en el paso anterior. Si el octeto aún no está completo, mueva un par más solitario de electrones de un átomo vecino: del mismo átomo para hacer un triple enlace, como en el caso del HCN anterior, o de otro átomo vecino para hacer dos dobles enlaces, como en el caso del CO 2 anterior. El resultado son las estructuras de Lewis que se muestran a continuación.

Para dibujar la estructura de Lewis de la forma más estable, trate de mantener enlaces covalentes con un átomo igual al número de puntos desapareados en el símbolo de Lewis de los átomos. Por ejemplo,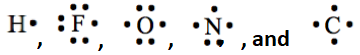 tener 1, 1, 2, 3 y 4 electrones desapareados. Entonces, el hidrógeno hace uno, flúor uno, oxígeno dos, nitrógeno 3 y carbono cuatro enlaces covalentes en las moléculas estables. Cuando se necesita extraer un par solitario de átomos vecinos para dar como resultado un doble o triple enlace, es preferible mantener el número resultante de enlaces covalentes igual al número de electrones desapareados en el símbolo de Lewis del átomo. Por ejemplo, en el caso de la molécula de CO 2, si ambos pares solitarios fueran sacados del mismo oxígeno en el paso 6 anterior, la estructura de Lewis resultante habría sido
tener 1, 1, 2, 3 y 4 electrones desapareados. Entonces, el hidrógeno hace uno, flúor uno, oxígeno dos, nitrógeno 3 y carbono cuatro enlaces covalentes en las moléculas estables. Cuando se necesita extraer un par solitario de átomos vecinos para dar como resultado un doble o triple enlace, es preferible mantener el número resultante de enlaces covalentes igual al número de electrones desapareados en el símbolo de Lewis del átomo. Por ejemplo, en el caso de la molécula de CO 2, si ambos pares solitarios fueran sacados del mismo oxígeno en el paso 6 anterior, la estructura de Lewis resultante habría sido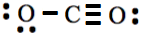 , que es técnicamente correcta estructura de Lewis pero no la forma más estable de esta molécula. Nótese que esta última estructura tiene un enlace covalente en un oxígeno y tres enlaces covalentes en el otro en lugar de dos enlaces covalentes necesarios para el oxígeno.
, que es técnicamente correcta estructura de Lewis pero no la forma más estable de esta molécula. Nótese que esta última estructura tiene un enlace covalente en un oxígeno y tres enlaces covalentes en el otro en lugar de dos enlaces covalentes necesarios para el oxígeno.
Excepciones a la regla del octeto
La regla del octeto generalmente se aplica en la mayoría de los casos, pero hay excepciones en algunos casos:
- Los átomos de hidrógeno, litio y berilio tienden a compartir, perder o ganar electrones de valencia para adquirir la configuración electrónica del helio de gas noble más cercano que tiene dos electrones de valencia. A esto se le llama la regla del dueto.
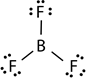
- A veces los átomos pueden terminar en compuestos con menos de ocho electrones de valencia. Esto suele ocurrir en el caso de compuestos de boro y compuestos de aluminio del grupo 13. Por ejemplo, el boro tiene tres electrones de valencia dando como resultado compuestos como BF 3 con tres enlaces covalentes y seis en lugar de ocho electrones de valencia alrededor del boro.
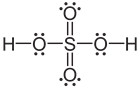
- Los átomos de los elementos en el período tres y más allá a veces terminan en compuestos con más de ocho electrones de valencia. Por ejemplo, PCl 3 tiene octeto completo, pero PCl 5 tiene 10 electrones de valencia. De igual manera, el azufre tiene su octeto completo en H 2 S pero tiene 12 electrones de valencia en H 2 SO 4. Esto sucede porque los átomos en el periodo ti y más allá tienen tamaños más grandes y tienen electrones de valencia en los orbitales d o f además de los orbitales de valencia s y p. En el Cuadro 1 se enumeran algunos ejemplos de excepciones a la regla del octeto.
|
Estructura |
H:H |
|
|
|
|
|---|---|---|---|---|---|
|
Nombre |
Hidrógeno |
Dicloruro de berilio |
Trifluoruro de boro |
Pentafluoruro de fósforo |
Ácido sulfúrico |
|
Electrones de valencia en el átomo central |
2 |
4 |
6 |
10 |
12 |