3.7: Formas moleculares: teoría de repulsión de pares de electrones de vaina de valencia (VSEPR)
- Page ID
- 77209
La estructura de Lewis dice la conexión entre los átomos y cualquier par solitario presente, pero no dice los ángulos exactos de los enlaces alrededor del átomo central o la forma real de la molécula. La forma convencional de presentar una estructura de Lewis de una molécula la muestra como una cepilladora, por ejemplo, CH 4 como lo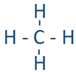 que implica que la molécula sea plana y que los ángulos de enlace H-C-H sean de 90 o 180 o. La molécula CH 4 real es no planar como
que implica que la molécula sea plana y que los ángulos de enlace H-C-H sean de 90 o 180 o. La molécula CH 4 real es no planar como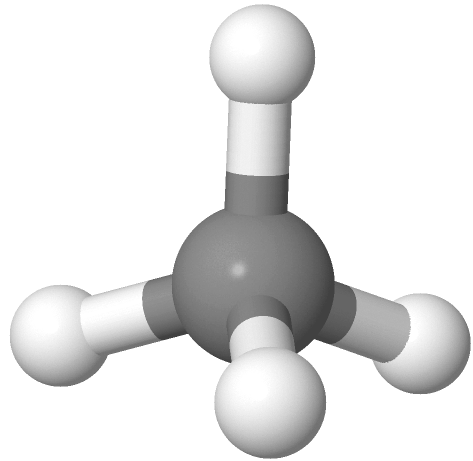 con todos los ángulos de enlace H-C-H 109.5 o. La siguiente teoría ayuda a explicar las formas reales de las moléculas.
con todos los ángulos de enlace H-C-H 109.5 o. La siguiente teoría ayuda a explicar las formas reales de las moléculas.
Teoría de repulsión de pares de electrones de concha de valencia (VSERP)
La teoría de repulsión de pares de electrones de la capa de valencia predice la forma de la molécula y los ángulos de enlace basándose en el hecho de que los electrones de la capa de valencia alrededor del átomo central en una molécula se agrupan. Los grupos de electrones se repelen entre sí y se alejan lo más posible entre sí.
Grupos de electrones
Un par solitario, un enlace sencillo, un doble enlace y un triple enlace, cada uno de estos es un grupo de electrones. Esto se debe a que dos elecciones de enlace sencillo, cuatro electrones de un doble enlace y seis electrones de un triple enlace se localizan en la región a lo largo del eje del enlace, es decir, se agrupan entre sí. De igual manera, un par solitario se ubica en un espacio definido alrededor del átomo. Por ejemplo, el carbono en metano (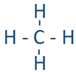 ) tiene cuatro grupos de electrones que son los cuatro enlaces simples (enlaces C-H) alrededor del carbono. El carbono en dióxido de carbono (O=C=O) tiene dos grupos de electrones que son los dos dobles enlaces alrededor del carbono, y en H-C=N tiene dos grupos de electrones que son un enlace sencillo (enlace C-H) y un triple enlace (enlace C=N).
) tiene cuatro grupos de electrones que son los cuatro enlaces simples (enlaces C-H) alrededor del carbono. El carbono en dióxido de carbono (O=C=O) tiene dos grupos de electrones que son los dos dobles enlaces alrededor del carbono, y en H-C=N tiene dos grupos de electrones que son un enlace sencillo (enlace C-H) y un triple enlace (enlace C=N).
Formas moleculares y ángulos de enlace basados en la teoría VSEPR
Un grupo de electrones
Un grupo de electrones entre dos átomos es siempre una molécula lineal. Por ejemplo, H-H, O=O, N=N y H-Cl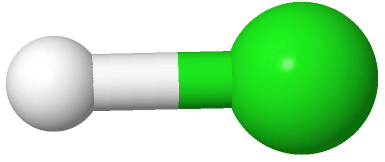 , son moléculas lineales, donde el hidrógeno es blanco y el cloro es verde en el modelo H-Cl.
, son moléculas lineales, donde el hidrógeno es blanco y el cloro es verde en el modelo H-Cl.
Grupos de dos electrones
Los grupos de dos electrones están más alejados en una geometría lineal con el átomo central en el centro de la línea y los ángulos de enlace de 180 o alrededor del átomo central. Los ejemplos incluyen CO 2 y HCN
y HCN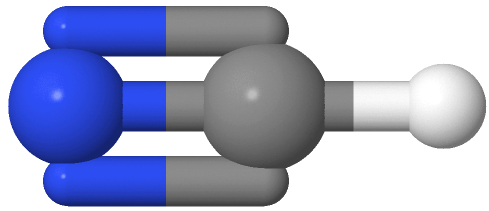 , donde el átomo de carbono central es gris, el hidrógeno es blanco, el nitrógeno es azul y el oxígeno es rojo.
, donde el átomo de carbono central es gris, el hidrógeno es blanco, el nitrógeno es azul y el oxígeno es rojo.
Grupos de tres electrones
Los grupos de tres electrones están más alejados cuando están en las esquinas de un triángulo en una geometría trigonal plana con el átomo central en el centro del triángulo y los ángulos de enlace de 120 o alrededor del átomo central. Los ejemplos incluyen BF 3 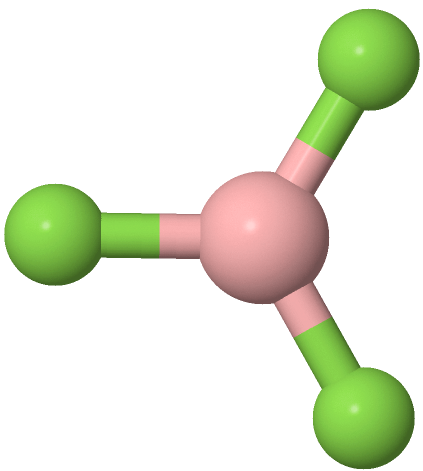 y H 2 CO
y H 2 CO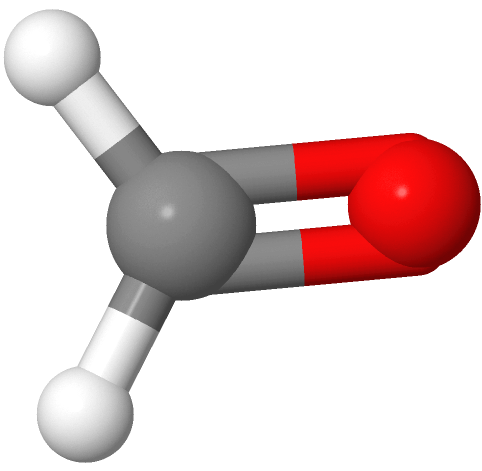 , donde el boro es rosa, F es verde, el carbono es gris, el oxígeno es rojo y el hidrógeno es blanco.
, donde el boro es rosa, F es verde, el carbono es gris, el oxígeno es rojo y el hidrógeno es blanco.
Si uno de los dominios de electrones es un par solitario, la geometría del dominio electrónico sigue siendo la misma, pero la geometría de los átomos en la molécula, es decir, la geometría de la molécula, está doblada. Por ejemplo,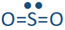 tiene tres dominios de electrones y geometría de dominio electrónico plano trigonal, pero hay un par solitario. Entonces, la geometría de la molécula se dobla como
tiene tres dominios de electrones y geometría de dominio electrónico plano trigonal, pero hay un par solitario. Entonces, la geometría de la molécula se dobla como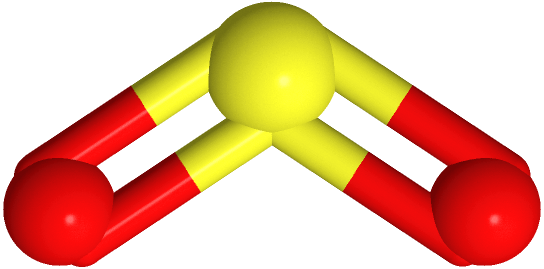 , donde el azufre es amarillo, y el oxígeno es rojo (par solitario en no se muestra).
, donde el azufre es amarillo, y el oxígeno es rojo (par solitario en no se muestra).
Grupos de cuatro electrones
Los grupos de cuatro electrones están más alejados cuando están en las esquinas de un tetraedro en una geometría tetraédrica con el átomo central en el centro del tetraedro y los ángulos de enlace de 109.5 o alrededor del átomo central como: . Un ejemplo es el metano CH 4
. Un ejemplo es el metano CH 4 , donde el carbono es gris, y los hidrógenos son blancos.
, donde el carbono es gris, y los hidrógenos son blancos.
Si uno de los dominios de electrones es un par solitario, la geometría del dominio electrónico sigue siendo tetraédrica, pero la geometría de la molécula es piramidal trigonal como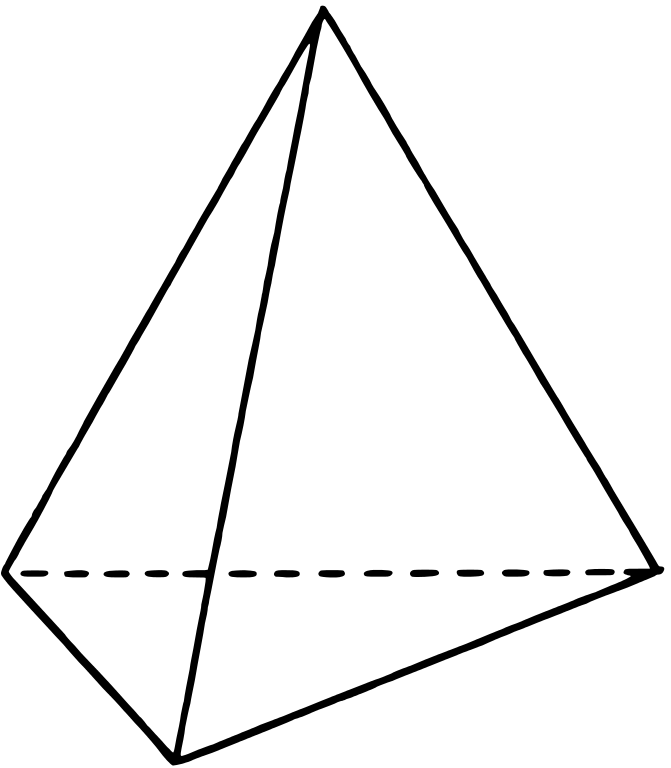 con tres átomos peréferales en las esquinas del triángel y el átomo central elevado a la parte superior de la pirámide. Un ejemplo es el amoníaco (:NH 3)
con tres átomos peréferales en las esquinas del triángel y el átomo central elevado a la parte superior de la pirámide. Un ejemplo es el amoníaco (:NH 3)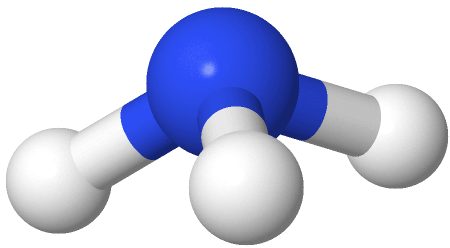 , donde el nitrógeno es azul, y los hidrógenos son blancos.
, donde el nitrógeno es azul, y los hidrógenos son blancos.
Si dos dominios de electrones son pares solitarios, la geometría de los dominios de electrones sigue siendo tetraédrica, pero la geometría de la molécula está doblada. Un ejemplo es el agua (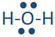
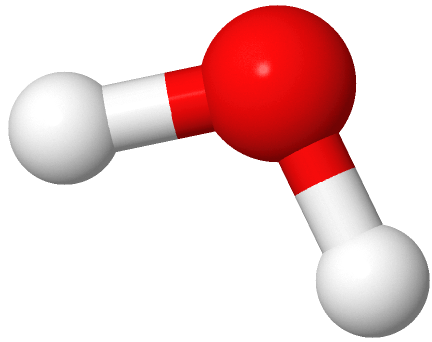 ), donde el oxígeno es rojo, y los hidrógenos son blancos.
), donde el oxígeno es rojo, y los hidrógenos son blancos.
El Cuadro 1 es el resumen de las geometrías del dominio electrónico y las correspondientes geometrías moleculares.
|
Dominio de electrones |
Par solitario |
Geometría de dominio electrónico |
Geometría de moléculas |
Ángulos de unión |
Ejemplos |
|---|---|---|---|---|---|
|
1 |
0 |
Lineal |
Lineal |
- |
HCl |
|
2 |
0 |
Lineal |
Lineal |
180 o |
CO 2 HCN |
|
3 |
0 |
Piramidal trigonal |
Piramidal trigonal |
120 o |
H 2 CO |
|
3 |
2 |
Piramidal trigonal |
Doblada |
120 o |
|
|
4 |
0 |
Tetraédrico |
Tetraédrico |
109.5 o |
CH 4 |
|
4 |
1 |
Tetraédrico |
Piramidal trigonal |
109.5 o |
:NH 3 |
|
4 |
2 |
Tetraédrico |
Doblada |
109.5 o |
|


