5.1: Introducción a la solución
- Page ID
- 77370
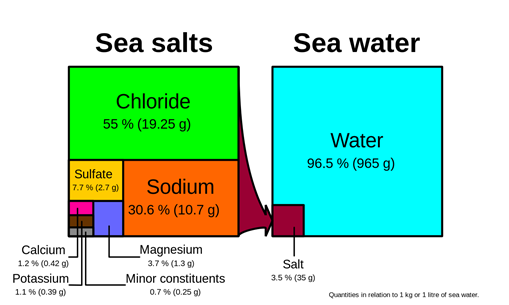
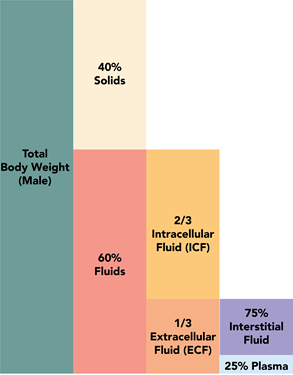
Las soluciones están a nuestro alrededor, por ejemplo, aire, agua de mar, fluidos corporales, aleaciones metálicas son soluciones. La figura 5.1.1 ilustra que el aire es una mezcla de nitrógeno, oxígeno, dióxido de carbono y algunos otros gases; la figura 5.1.2 ilustra que el agua de mar es una mezcla de agua, cloruro, sodio, sulfato, magnesio y algunos otros iones, y la figura 5.1.3 ilustra que aproximadamente el 60% del cuerpo humano está compuesto por soluciones. llamados fluidos corporales.
¿Qué es una solución?
- Una solución es una mezcla homogénea de dos o más sustancias puras.
- A la sustancia que se encuentra en gran cantidad en la solución se le llama el solvente.
- A la sustancia que se encuentra en cantidades menores en una solución se le llama soluto.
Por ejemplo, el aire es una solución en la que el nitrógeno es el disolvente, y el agua es el disolvente en el agua de mar y los fluidos corporales. El oxígeno, el dióxido de carbono y los vapores de agua son solutos en el aire; y el sodio, el cloruro, el sulfato, el magnesio y algunos otros iones son solutos en el agua de mar.
Tipos de solución
Las soluciones generalmente se clasifican de dos maneras: i) según el estado físico de la solución y el soluto, y ii) en función del tamaño de partícula del soluto.
Tipos de solución basados en el estado físico de la solución y el soluto
Las soluciones se pueden clasificar en función del estado físico de la solución, el disolvente y el soluto. Por ejemplo, el aire es gas en una solución de gas; el agua carbonatada es un gas en una solución líquida; el vinagre es un líquido en una solución líquida; las aleaciones metálicas son sólidas en soluciones sólidas. En el Cuadro 5.1.1 se enumeran los principales tipos de soluciones, solventes y solutos primarios en ellos.
|
Tipo |
Ejemplo |
solvente |
Soluto primario |
|---|---|---|---|
|
Gas en gas |
Aire |
Nitrógeno |
Oxígeno |
|
Gas en líquido |
Agua carbonatada |
Agua |
Dióxido de carbono |
|
Líquido en líquido |
Vinagre |
Agua |
Ácido acético |
|
Sólido en líquido |
Agua de mar |
Agua |
Cloruro de sodio |
|
Sólido en sólido |
Latón |
Cobre |
Zinc |
Tipos de soluciones basadas en el tamaño de partícula del soluto
Una solución es una mezcla homogénea que comprende componentes/es más pequeños llamados soluto/s de moléculas pequeñas o iones comparables en tamaño a las moléculas de un componente más grande llamado solvente.
Por ejemplo, el NaCl disuelto en agua es una solución. El soluto se distribuye casi uniformemente en el disolvente, haciendo una mezcla homogénea. El soluto no se separa por filtración o por una membrana semipermeable sino que puede separarse por algún otro proceso físico. Por ejemplo, el proceso de destilación separa un sólido en un líquido o un líquido en una solución líquida. La solución es transparente, aunque puede ser coloreada. Una luz que pasa a través de una solución no es visible, como se muestra en la Fig. 5.1.4.


Una suspensión es una mezcla heterogénea de partículas de solvente y soluto mayores de 10,000 Å.
Por ejemplo, el agua fangosa es una suspensión. Si se deja reposar la suspensión, las partículas suspendidas se asientan y se separan. Las partículas suspendidas pueden ser filtradas. Algunos medicamentos, por ejemplo, la leche de magnesia, son suspensiones. Se instruye agitar justo antes de administrar el medicamento para volver a suspender la suspensión asentada.
Un coloide cae entre una solución y una suspensión. Las partículas coloidales son moléculas más grandes como proteínas o grupos de moléculas o iones.
A diferencia de una suspensión, los coloides generalmente no se asientan si se les deja reposar. Las partículas coloidales no pueden filtrarse pero pueden separarse por una membrana semipermeable. Cuando un haz de luz pasa a través de un coloide, se dispersa por las partículas coloidales, llamadas efecto Tyndall, y se vuelve visible, como se muestra en la Fig. 5.1.4.
Los ejemplos de coloides incluyen:
- niebla y nubes que son gotas de agua líquida dispersas en el aire;
- humo que es partículas de carbono sólidas dispersas en el aire;
- crema batida que es aire dispersado en un líquido;
- espuma de poliestireno es un gas dispersado en un sólido; y
- medio ager que es líquido disperso en un medio sólido.
Agua: un solvente universal
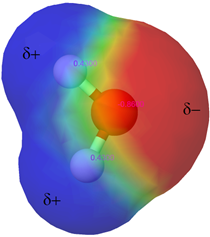
El agua (H 2 O) es una sustancia esencial para la vida. Cubre más del 70% de la superficie terrestre (Fig. 5.1.5), y comprende más del 60% del cuerpo humano (5.1.3). Además de ser el disolvente más abundante, el agua es un disolvente universal porque es una molécula polar con una carga parcial negativa sobre el oxígeno y una carga positiva parcial sobre los átomos de hidrógeno como se muestra en la Fig. 5.1.6. La polaridad de las moléculas de agua les permite interactuar con otras moléculas de agua así como con otros compuestos polares a través de interacciones dipolo-dipolo y con otros iones a través de interacciones ión-dipolo. Estas interacciones ayudan a disolver una gran cantidad de compuestos polares e iónicos que se encuentran dentro y alrededor de nosotros.

¿Cómo disuelve el agua los compuestos polares e iónicos?
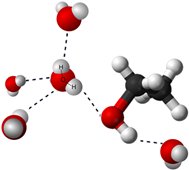
Las moléculas de agua establecen interacción electrostática, llamada enlace de hidrógeno, a través del extremo +ve parcial de una molécula con un extremo —ve parcial de una molécula vecina. Estas interacciones imparten propiedades únicas al agua, como su punto de ebullición y punto de fusión relativamente más altos en comparación con otras sustancias de peso molecular similar. Otras sustancias polares tienen interacciones similares, por ejemplo, el etanol tiene enlaces de hidrógeno similares al agua como se ilustra en la Fig. 5.1.7.
Cuando el agua se mezcla con otras sustancias polares, como el etanol, algunos de los enlaces de hidrógeno entre las moléculas de agua reemplazan con enlaces de hidrógeno similares con moléculas de etanol. Dado que la energía potencial electrostática es similar, la tendencia natural a ir hacia una mayor dispersión impulsa la dispersión de las moléculas de etanol de manera uniforme en agua dando como resultado la solución.
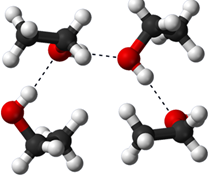
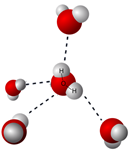
Los compuestos iónicos se mantienen unidos por fuerzas electrostáticas entre iones opuestos, es decir, enlaces iónicos. Cuando se agrega un compuesto iónico al agua, las moléculas de agua rodean el catión y establecen la interacción ión-dipolo orientando su extremo parcial -ve al catión. De manera similar, las moléculas de agua establecen interacción ión-dipolo con aniones orientando su extremo +ev parcial hacia el anión, como se ilustra en la Fig. 5.1.8
Las interacciones ión-dipolo, junto con la tendencia de la naturaleza a dispersar las partículas, suelen ser lo suficientemente fuertes como para superar los enlaces iónicos, disociar los compuestos en iones y dispersarlos casi uniformemente en el agua.
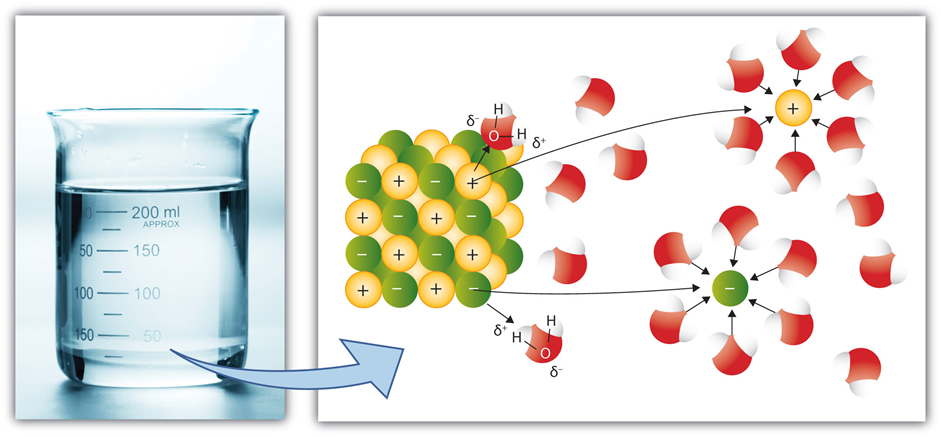
La separación de los cationes de los aniones del compuesto iónico se denomina disociación.
La formación de una capa de moléculas de agua alrededor de los iones, impulsada por interacciones ión-dipolo, se llama hidratación.
Las sustancias no polares, como el aceite vegetal o la gasolina, no se disuelven en agua. Las moléculas en sustancias no polares solo tienen fuerzas de dispersión de Londres. Se disuelven fácilmente en disolventes no polares como hexano o tetracloruro de carbono que tienen fuerzas de dispersión similares en Londres entre sus moléculas.
El hecho de que las sustancias iónicas y polares se disuelvan en disolventes polares y las sustancias no polares se disuelvan en disolventes no polares de interacciones intermoleculares similares se denomina “como se disuelve”.


