5.2: Solubilidad
- Page ID
- 77342
Solubilidad y sus terminologías relacionadas
La mayoría de los solutos no se disuelven en agua u otros solventes en todas las proporciones.
Qué es la solubilidad
La proporción máxima del soluto que puede disolverse en una cantidad dada del disolvente, generalmente expresada en gramos de soluto en 100 gramos de disolvente, se denomina solubilidad del soluto en el disolvente.
- Las sustancias que hacen una solución cuando se mezclan en cualquier proporción se denominan miscibles. Por ejemplo, el etanol y el agua son miscibles.
- Algunas sustancias hacen una solución cuando se mezclan en alguna proporción pero no en todas las proporciones; estas se denominan parcialmente miscibles. Por ejemplo, el n-butanol puede mezclarse en agua hasta 7.3 g n-butanol/100 ml de agua.
- Las sustancias que casi no se disuelven entre sí se llaman inmiscibles. Por ejemplo, el n-hexano es inmiscible en agua.
- La solución que aún no ha alcanzado sus límites de solubilidad y puede disolver más soluto agregado se denomina solución insaturada.
- La solución que ha alcanzado sus límites de solubilidad y no puede disolverse si se le agrega más soluto se llama solución saturada.
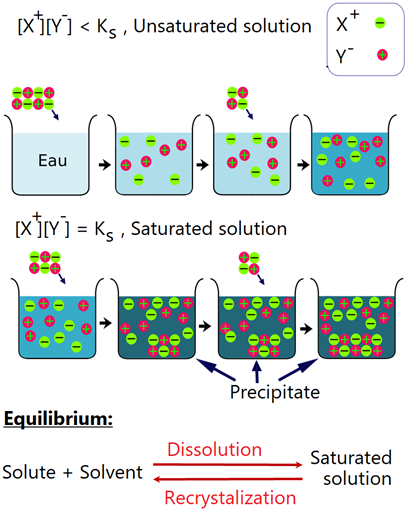
Cuando se agrega un soluto a una solución saturada, sí se disuelve, pero, al mismo tiempo, los componentes disociados se recombinan para formar los cristales del soluto, es decir, recristalizar, a la misma velocidad, de manera que no haya disolución neta, como se ilustra en la Fig. 5.2.1.
Efecto de la temperatura sobre la solubilidad
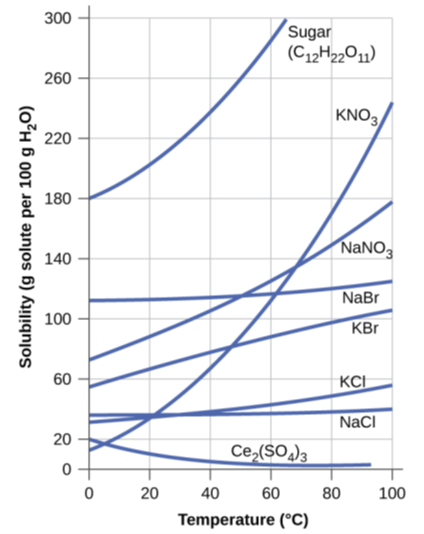
La solubilidad de la mayoría de los sólidos y líquidos aumenta a medida que aumenta la temperatura.
Por ejemplo, cuando se calienta una solución saturada de azúcar en agua, puede disolver más azúcar. La Fig 5.2.2 muestra las curvas de solubilidad vs temperatura para algunos compuestos.
Cuando se enfría una solución saturada caliente, la concentración de soluto en la solución se vuelve por encima de los límites de solubilidad, haciendo una solución sobresaturada.
La solución sobresaturada es inestable y finalmente cristaliza el exceso de soluto dejando cualquier impureza en la solución, como se ilustra en la Fig. 5.2.3. Este proceso se llama recristalización, que se utiliza para purificar los solutos.

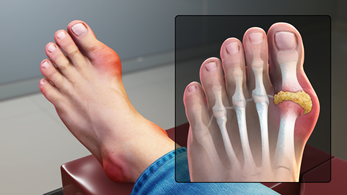
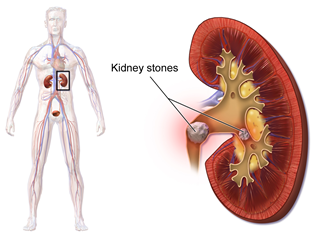
La cristalización del exceso de soluto a partir de una solución sobresaturada es responsable de algunos problemas médicos como la gota y el cálculos renales. La gota es la cristalización del ácido úrico en el cartílago, tendones y tejidos blandos cuando la concentración del ácido úrico en los plasmas sanguíneos supera su límite de solubilidad de ~7 mg/100 mL a 37 o C. Provoca enrojecimiento, hinchazón y dolor en la zona afectada, como se ilustra en la Fig. 5.2.4. Los cálculos renales son materiales sólidos formados en las trompas urinarias, como se ilustra en la Fig. 5.2.5. Los cálculos renales son el resultado de la cristalización del exceso de fosfato de calcio, oxalato de calcio o ácido úrico en la orina.
Frente a los sólidos y líquidos, la solubilidad de los gases generalmente disminuye con un aumento de la temperatura.
Es por ello que el agua carbonatada libera gas disuelto al calentarse, provocando un aumento de presión, lo que a su vez provoca el estallido de la lata de soda
Efecto de la presión sobre la solubilidad
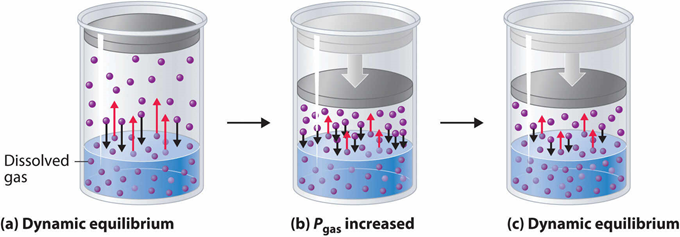
La presión casi no tiene efecto sobre la solubilidad de sólidos y líquidos pero tiene un fuerte efecto sobre la solubilidad de los gases.
La solubilidad de los gases en líquidos es directamente proporcional a la presión del gas por encima del líquido.
Un aumento en la presión provoca una disminución en el volumen de gas que aumenta la concentración de gas. La colisión más frecuente de las moléculas de gas con el límite gas-líquido en una solución concentrada provoca un aumento en la velocidad de disolución del gas en el líquido, como se ilustra en la Fig 5.2.6. Ocurre lo contrario cuando disminuye la presión del gas. Por ejemplo, el dióxido de carbono comienza a burbujear cuando una lata de soda está abierta porque el gas se escapa dando como resultado una disminución en la presión del gas por encima del líquido y una disminución en la solubilidad del gas en el agua.
Lineamientos de solubilidad para la disolución de compuestos iónicos en agua
Si la solubilidad de un compuesto es inferior a 0.01 mol/L, se considera insoluble.
La solubilidad de los compuestos iónicos en agua depende de la naturaleza del compuesto. Por ejemplo, el yoduro de plomo (II) (PbI 2) y el cloruro de plata (AgCl) son insolubles en agua debido a que la solubilidad de PbI 2 es 0.0016 mol/L de la solución y la solubilidad de AgCl es de aproximadamente 1.3 x 10 -5 mol/L de solución. El yoduro de potasio (KI) y Pb (NO 3) 2 son solubles en agua. Cuando se mezclan soluciones acuosas de KI y Pb (NO 3) 2, la concentración de PbI 2 en la mezcla va por encima de sus límites de solubilidad, y precipita, como se ilustra en la Fig. 5.2.7.

No existen pautas a prueba de fallas para predecir la solubilidad de compuestos iónicos en agua. Sin embargo, la siguiente guía puede predecir la solubilidad de la mayoría de los compuestos iónicos.
- Las sales de metales alcalinos (Li 1 +, Na 1 +, K 1+, Rb 1 +, Cs 1 +) y amoníaco (NH 4 1 +) son solubles. Sin excepciones.
- Las sales de nitrato (NO 3 1 -), acetato (CH 3 COO 1 -) y perclorato (ClO 4 1 -) son solubles. Sin excepciones.
- Las sales de cloruro (Cl 1 -), bromuro (Br 1 -) y yoduro (l 1-) son solubles, excepto cuando el catión es Pb 2 +, Hg 2 2 -, o Ag 1 +. (Recuerda el acrónimo “LMS” basado en la primera letra del nombre del elemento, o la frase 'Let Me See” para recordar Plomo, Mercurio y Plata.)
- Los sulfatos (SO 4 2 -) son solubles excepto cuando el catión Pb 2 +, Hg 2 2 -, Ag 1 +, o un metal alcalinotérreo pesado iones: calcio (Ca 2 +), bario (Ba 2 +), o estroncio (Sr 2 +). ((recuerde “Let Me See” para Plomo, Mercurio y Plata. Recuerda el acrónimo “CBS” basado en la primera letra del nombre del elemento, o la frase “Come By Soon” para recordar calcio, bario y estroncio.)
- El hidróxido (OH 1 -) y los sulfuros (S 2-) son insolubles excepto cuando el catión es un metal alcalino, amoníaco o iones de un metal alcalinotérreo pesado: Ca 2 +, Ba 2 + y Sr 2 +. (Recordemos la frase “Come By Soon” para recordar calcio, bario y estroncio.)
- Los carbonatos (CO 3 2 -), los fosfatos (PO 4 3 -) y el óxido (O 2-) son insolubles excepto cuando el catión es un metal alcalino, amoníaco
- Si existe un conflicto entre los dos lineamientos, entonces la pauta listada primero tiene prioridad. Por ejemplo, las sales de iones insolubles se vuelven solubles cuando el catión es un metal alcalino, el amoníaco (regla #1).




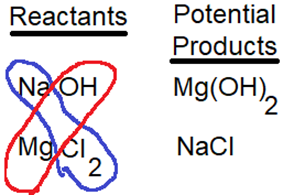
La Fig. 5.2.8 muestra precipitados de algunos compuestos iónicos insolubles formados mezclando soluciones acuosas de compuestos iónicos solubles apropiados. La precipitación se puede predecir, como se ilustra en la Fig. 5.2.9. Enumere los iones de los compuestos iónicos solubles y luego combine los cationes de uno con el anión del otro para hacer los productos potenciales. Si alguno de los productos potenciales es un compuesto iónico insoluble, precipita.