7.1: Características de los gases
- Page ID
- 77275
Qué es un gas
El gas es uno de los cuatro estados de la materia que cae entre el estado líquido y el plasma. El aire que nos rodea es un gas compuesto por ~ 78% de nitrógeno (N 2), ~ 21% de oxígeno, y el restante ~ 1% son otros gases, incluyendo dióxido de carbono, vapores de agua, argón, etc., como se ilustra en la Fig. 7.1.1.
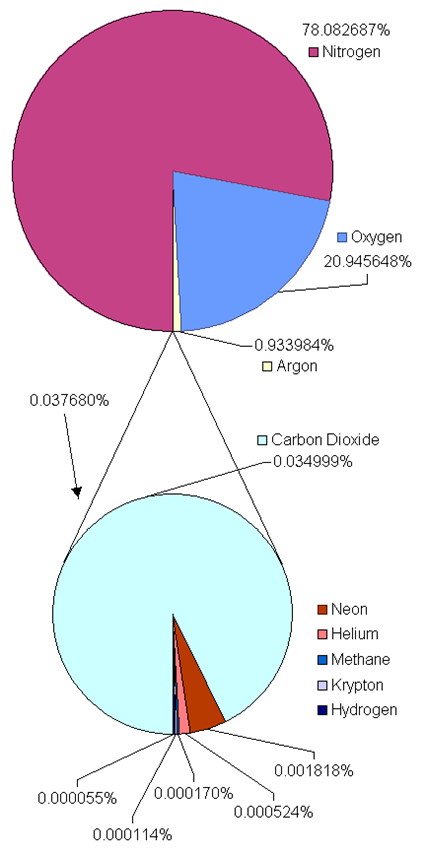
Los elementos que existen como gases a temperatura ambiente y presión atmosférica incluyen gases nobles que son moléculas monoatómicas como helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn), y moléculas elementales diatómicas que incluyen hidrógeno (H 2), nitrógeno (N 2 ), oxígeno (O 2) y dos halógenos: flúor (F 2) y cloro (Cl 2). Existen varios compuestos moleculares como gases a temperatura ambiente, por ejemplo, dióxido de carbono (CO 2), monóxido de carbono (CO), metano (CH 4), dióxido de nitrógeno (NO 2), dióxido de azufre (SO 2), sulfuro de hidrógeno (H 2 S), amoníaco (NH 3).
Las propiedades de los gases se definen por su cantidad en moles (n), volumen (V), temperatura (T) y presión (P). Estos parámetros se describen a continuación.
La cantidad de un gas
La cantidad de gas se mide en moles (n), es decir, 6.022 x 10 23 moléculas de un gas es un mol del gas. El gas tiene masa y se puede medir en unidades de masa como gramos o kilogramos, pero la masa necesita dividirse por la masa molar del gas para obtener la cantidad en moles para los cálculos.
La cantidad de gas en moles es necesaria en las leyes de gas porque las propiedades de los gases son proporcionales al número de moléculas, no a las masas de las moléculas.
¿Cuántos moles hay en 10.0 g de gas oxígeno?
Solución
Paso 1. Dado: Masa = 10.0 g O 2, Deseada:? moles de O 2.
Paso 2. Igualdad entre las unidades dadas y las deseadas: 1 mol de O 2 = 32.00 g O 2.
Paso 3. Los factores de conversión a partir de la igualdad:\(\frac{1~mol~O_2}{32.00~g~O_2}\) y\(\frac{32.00~g~O_2}{1~mol~O_2}\)
Paso 4. Multiplique la cantidad dada con el factor de conversión que cancela la dada y deja la unidad deseada en la respuesta:\[10.0 \cancel{~g~O_2)}\times\frac{1~mol~O_2}{32.00\cancel{~g~O_2}} = 0.312 ~g~O_2\nonumber\]
El volumen de un gas
Volumen (V) es el espacio que ocupa una sustancia. La unidad de volumen SI es un cubo medidor (m 3), es decir, el espacio dentro de un cubo de 1m x 1m x 1m.
Por lo general, el volumen se reporta en litros (L), que es dm 3, o mililitro (mL), que es cm 3. La relación entre las unidades de volumen es la siguiente.
\[1 \mathrm{~m}^{3}=1000 \mathrm{~L}\nonumber\]
\[1 \mathrm{~L}=1000 \mathrm{~mL}\nonumber\]
Los gases no tienen una forma o volumen fijo. Los gases adquieren la forma del contenedor. Los gases se expanden o contraen para llenar el espacio disponible en un contenedor.
La temperatura de un gas
La temperatura (T) es una medida de lo caliente o frío que es un objeto.
La temperatura es una manifestación de la energía térmica de una sustancia. La energía térmica es una fuente de calor. El calor es el flujo de energía de un objeto caliente a uno frío. La unidad de temperatura SI es Kelvin (K) que tiene un valor de 273.15 K en el punto de congelación del agua y 375.15 K en el punto de ebullición del agua. El cero de la escala kelvin se llama el cero absoluto en el que no puede fluir más energía de una sustancia como calor. No hay un número negativo en la escala Kelvin de temperatura.
Otras unidades de temperatura comúnmente utilizadas son Celsius (o C) que tiene un valor de 0 o C en el punto de congelación del agua y 100 o C en el punto de ebullición del agua. La relación entre la temperatura en Kelvin (T K) y la temperatura en Celsius (T C) es la siguiente.
\[T_{K}=T_{C}+273.15\nonumber\]
Fahrenheit es una escala de temperatura utilizada en el sistema inglés de medición que tiene un valor de 32 o F en el punto de congelación del agua y 212 o F en el punto de ebullición del agua. La relación entre la temperatura en Fahrenheit (T F) y la temperatura en Celsius (T C) es la siguiente.
\[T_{F}=\frac{9}{5} T_{C}+32\nonumber\]
La temperatura en Kelvin (K) se utiliza en los cálculos de la ley de gases.
La presión de un gas
La presión (P) es la fuerza (F) por unidad de área (A), es decir,\(P = \frac{F}{A}\).
La materia tiene masa y aplica una fuerza, que es el peso debido a la atracción gravitacional. Por ejemplo, una columna de 1 m x 1m a nivel del mar y altura igual a la atmósfera terrestre, como se ilustra en la Fig. 7.1.2 tiene una masa de ~10,000 kg. Mercurio (Hg) relleno en una columna de 1 m x 1m y altura 0.760 m tiene la misma masa que la masa de aire de 1 m x 1 m columna que se extiende desde el nivel del mar hasta toda la atmósfera de la tierra.

Una columna de aire que se extiende desde el nivel del mar hasta toda la atmósfera aplicó una presión igual a una atmósfera (atm), donde atm es la unidad de presión. Una atmósfera (atm) es igual a 760 milímetros de mercurio (mmHg), donde mmHg es otra unidad de presión. Un mmHg también se llama Torr. La relación entre atm, mmHg y Torr es la siguiente.
\[1\mathrm{~atm}=760 \mathrm{~mmHg} = 760 \mathrm{~Torr}\nonumber\]
La unidad de presión SI es pascal (Pa), que es la presión (P) aplicada por una fuerza (F) de un newton (N) sobre un área de un metro cuadrado (m 2). La forma matemática de la unidad es:\(1 ~Pascal = \frac{1~Newton}{1 ~meter-square}\) o\(Pa = \frac{N}{m^2}\)
Kilopascal es 1000 Pa, y kilopascal también se llama la barra. La unidad de presión del sistema inglés es de fuerza por pulgada cuadrada (psi). La relación entre las diferentes unidades de presión mencionadas anteriormente es la siguiente.
\[1 \mathrm{~atm}=760 \mathrm{~mm} \mathrm{Hg}=760 \mathrm{~Torr}=1.01325 \times 10^{5} \mathrm{~Pa}=1.01325 \times 10^{2} \mathrm{~kP}=1.01325 \mathrm{~bar}=14.7 \mathrm{~psi}\nonumber\]
Estas relaciones se cambian a factores de conversión que permiten la conversión de una a otra unidad de presión, como se explica en los siguientes ejemplos.
Exprese 51 mm Hg en a) atm y b) en Pa.
Solución
Dado: Presión = 51 mm Hg. Requerido: presión en atm y Pa
Relación entre mm Hg y atm:\(1\mathrm{~atm}=760 \mathrm{~mm Hg}\nonumber\)
Los factores de conversión a partir de la igualdad:\(\frac{1 \mathrm{~atm}}{760 \mathrm{~mm} \mathrm{Hg}}\nonumber\) y\(\frac{760 \mathrm{~mm} \mathrm{Hg}}{1 \mathrm{~atm}}\nonumber\)
Cálculos: multiplique la cantidad dada con el factor de conversión que cancela la unidad dada y deja la unidad deseada en la respuesta.
\[51 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1 \mathrm{~atm}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=6.7 \times 10^{-2} \mathrm{~atm}\nonumber\]
De igual manera, la relación entre mm Hg y Pa:\(760 \mathrm{~mm Hg}=1.01325 \times 10^{5} \mathrm{~Pa}\nonumber\)
Los factores de conversión a partir de la igualdad:\(\frac{760 \mathrm{~mm Hg}}{1.01325 \times 10^{5} \mathrm{~Pa}}\nonumber\) y\(\frac{1.01325 \times 10^{5} \mathrm{~Pa}}{760 \mathrm{~mm Hg}}\nonumber\)
Cálculos: multiplique la cantidad dada con el factor de conversión que cancela la unidad dada y deja la unidad deseada en la respuesta.
\[51 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1.01325 \times 10^{5} \mathrm{~Pa}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=6.8 \times 10^{3} \mathrm{~Pa}\nonumber\]
Medición de presión de gas
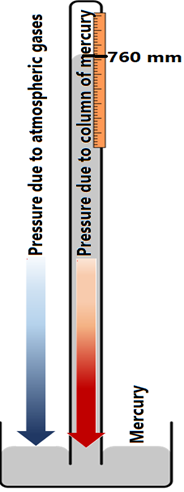
El instrumento utilizado para medir la presión atmosférica se llama barómetro.
El barómetro, mostrado en la Fig. 7.1.3, fue inventado por Evangelista Torricelli. Se trata de un tubo de vidrio que mide más de 760 mm de largo y está cerrado en un extremo. El tubo de vidrio se llena de mercurio y se invierte para sumergir su extremo abierto en un plato que contiene una capa de mercurio. El mercurio cae del tubo debido a su peso pero deja de caer cuando la columna de mercurio tiene 760 mm de altura a nivel del mar debido a la presión atmosférica que la empuja de nuevo al tubo. Recuerda 760 mmHg = 1 atm. Por encima de 760 mm hay un vacío en el tubo.
La presión de los gases en un laboratorio generalmente se mide utilizando un instrumento llamado manómetro.
Un manómetro es un tubo de vidrio en forma de U parcialmente lleno de mercurio, como se muestra en la Fig. 7.1.4. Un extremo del tubo en U está conectado a una cámara de gas en la que se está midiendo la presión, y el otro extremo está cerrado (con un vacío en el extremo cerrado), llamado manómetro de extremo cerrado, o bien está abierto a la atmósfera, llamado manómetro de extremo abierto.

En el caso de un manómetro de extremo cerrado, la presión del gas es igual a la diferencia en la altura del mercurio en los dos brazos del tubo en U en mmHg, es decir, altura (h) del punto N al punto B en unidades mm como se muestra en la Fig. 7.1.4.
Calcular la presión en atm para el gas mostrado en la Fig. 7.1.4 en el manómetro cerrado si h = 40 mm?
Solución
En un manómetro de extremo cerrado, la presión del gas es igual a la altura h en mm Hg: P = 40 mm Hg.
Presión en atm:
\[40 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1 \mathrm{~atm}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=5.3 \times 10^{-2} \mathrm{~atm}\nonumber\]
En el caso de un manómetro abierto, la presión del gas es igual a la diferencia en la altura del mercurio en los dos brazos del tubo en U en mm de Hg más la presión atmosférica exterior expresada en mm de Hg.
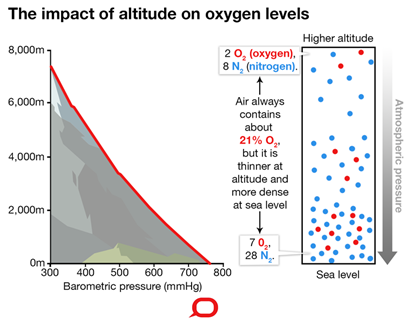
Variación de la presión del aire con la altitud
La presión del aire disminuye, y la concentración de gas disminuye a medida que aumenta la altitud, como se ilustra en la Fig. 7.1.5. La concentración de oxígeno en el aire también disminuye a medida que aumenta la altitud. Es por ello que los alpinistas experimentan un suministro inadecuado de oxígeno al cuerpo a grandes altitudes -una condición médica llamada hipoxia.
Presión arterial
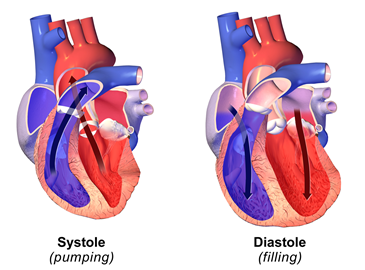
El corazón bombea la sangre al sistema circulatorio. Cuando el corazón se contrae, aplica la presión sobre la sangre que contiene, y la sangre bombea fuera del corazón hacia el sistema circulatorio, como se ilustra en la Fig. 7.1.6. La presión arterial en el sistema circulatorio es más alta en este punto, y se llama presión sistólica. Puede estar en el rango de 100 a 200 mm Hg. Un rango de presión sistólica deseable es de 100 a 120 mm Hg. Cuando los músculos del corazón se relajan, la cavidad en el corazón se expande y más sangre se llena en el corazón. La presión arterial en el sistema circulatorio es mínima en este punto, y se llama presión diastólica. La presión diastólica puede variar en el rango de 60 a 110 mm Hg. Una presión diastólica deseable es menor a 80 mm Hg.
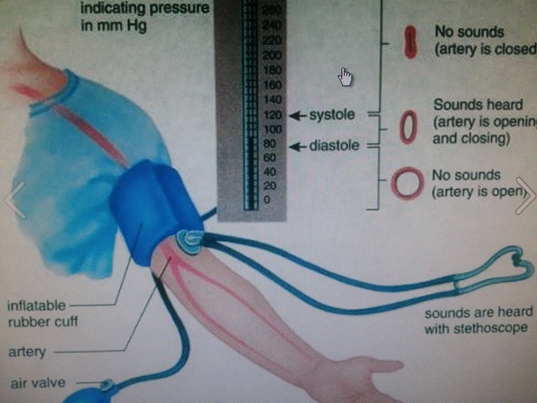
El dispositivo utilizado para medir la presión arterial se llama esfigmometro. Consiste en un manguito que envuelve la parte superior del brazo, una bomba para inflar el aire en el manguito y un estetoscopio para escuchar el sonido del flujo sanguíneo, como se ilustra en la Fig. 7.1.7. El manguito se infla con aire a una presión por encima de la presión sistólica y resulta en cortar el flujo sanguíneo a través de la arteria braquial en la parte superior del brazo. Se utiliza un estetoscopio para escuchar el sonido del flujo sanguíneo. En este momento no se escucha ningún sonido. La presión en el manguito se reduce lentamente. Cuando la presión en el manguito es igual a la presión sistólica, la sangre comienza a brotar hacia la arteria y se escucha un sonido de golpeteo a través del estetoscopio. En el punto en que la presión es igual a la presión diastólica, la sangre fluye libremente a través de la arteria, y el sonido de golpeteo desaparece. La lectura de la presión arterial se reporta como un conjunto de dos números, por ejemplo, 120/80, donde el mayor número es sistólico, y el número menor es la presión diastólica.
Teoría molecular cinética de los gases
Las características físicas de los gases son explicables mediante un modelo denominado teoría molecular cinética de los gases, ilustrado en la Fig. 7.1.8.
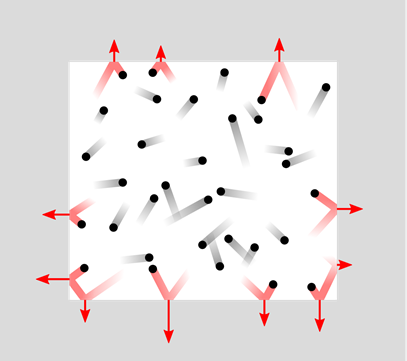
- Los gases consisten en partículas llamadas moléculas que están muy separadas entre sí. Como consecuencia de las vastas distancias, las fuerzas intermoleculares son insignificantes, y el volumen ocupado por las moléculas de gas es insignificante.
- Las moléculas de gas se mueven en líneas rectas en direcciones aleatorias hasta que chocan con otra molécula o con la pared del contenedor.
- Las colisiones son elásticas, es decir, se conserva la energía total, pero las moléculas cambian de dirección y cambian de velocidad después de la colisión. Se traduce en la distribución de velocidades moleculares en un amplio rango.
- La energía cinética promedio de las moléculas de gas es directamente proporcional a la temperatura absoluta. La energía cinética promedio de las moléculas de diferentes gases es la misma a la misma temperatura.
Explicación de las características de los gases con base en la teoría molecular cinética de los gases
- Al exponer el gas al vacío, las moléculas de gas se mantienen moviéndose en un camino recto en el vacío hasta que chocan con el límite de un contenedor y rebotan. Explica que los gases son expandibles. Las colisiones de moléculas de gas con la pared ejercen presión hacia afuera sobre la pared y, como reacción, la pared ejerce una presión interna igual sobre el gas. La aplicación de más presión al gas a través de cualquier porción del límite de gas perturba el equilibrio de acción y fuerzas de reacción mencionado anteriormente, lo que resulta en un movimiento hacia adentro de la porción de la superficie límite. Es decir, los gases son compresibles.
- Si se elimina un límite que separa dos gases, los movimientos moleculares aleatorios finalmente mezclan los dos gases formando una mezcla homogénea, es decir, los gases son completamente miscibles con otros gases.
- Cuando la temperatura aumenta las moléculas de gas se mueven más rápido y coloide con mayor frecuencia, lo que explica el hecho de que los gases ejercen más presión al calentarse y se expanden si el límite no es rígido. El estallido más frecuente de llantas en verano se debe al aumento de presión debido al calentamiento.
- Cuando más gas llena el neumático, la presión aumenta debido a colisiones más frecuentes. Comprimiendo el gas en menor volumen tiene el mismo efecto, es decir, las colisiones moleculares aumentan aumentando la presión.
Las características físicas de los gases son independientes de la naturaleza de las moléculas de gas debido a interacciones intermoleculares insignificantes pero dependen de cuatro propiedades físicas, es decir, presión, volumen, temperatura y cantidad de gas. En las siguientes secciones se describen las relaciones entre las propiedades físicas de los gases.


