7.2: La relación presión-volumen
- Page ID
- 77276
Relación presión-volumen
Considera un gas en un cilindro con un pistón empujándolo hacia abajo debido a objetos masivos colocados sobre él y debido a la presión del aire exterior, como se ilustra en la Fig. 7.2.1, Las moléculas de gas golpean la superficie del pistón, aplicando presión hacia arriba igual a la presión hacia abajo aplicada por el pistón que mantiene el pistón estacionario. El aumento de la presión sobre el pistón, por ejemplo, al agregarle más peso, hace que el pistón se mueva hacia abajo, reduciendo el volumen de gas. Las moléculas de gas tienen menos distancia para recorrer antes de golpear la superficie del pistón, lo que aumenta la frecuencia de colisión y hace que la presión del gas aumente hasta que sea igual a la presión exterior.
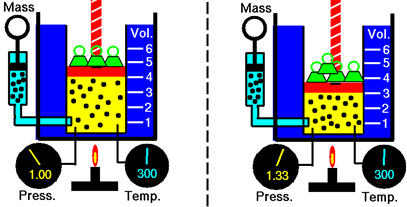
Cuando un cambio en un parámetro provoca un cambio en otro, los parámetros están relacionados. Cuando un aumento en un parámetro provoca una disminución en otro, los dos son inversamente proporcionales entre sí. Robert Boyle estudió la relación cuantitativa entre el volumen y la presión del gas, manteniendo la cantidad de gas y la temperatura constantes. La investigación concluyó en una ley llamada Ley de Boyle, que establece que:
El volumen de un gas es inversamente proporcional a la presión del gas siempre que la temperatura y la cantidad del gas permanezcan constantes.
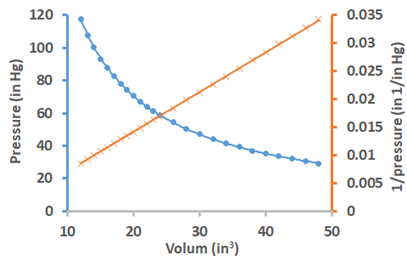
La Fig. 7.2.2 ilustra los resultados del experimento de Boyle. La forma matemática de la ley de Boyle es:\[V \propto \frac{1}{P}\nonumber\], o\[V=\frac{\mathrm{k}}{P}\nonumber\], o\[PV=\mathrm{k}\nonumber\], donde k es un consant. El gráfico de volumen versus presión es curvilíneo, pero el gráfico de volumen versus el recíproco de presión es un gráfico lineal que muestra la proporcionalidad inversa entre el volumen y la presión. Dado que el producto PV es una constante, implica que:\[P_{1} V_{1}=P_{2} V_{2}={k}\nonumber\], es decir, un producto de presión inicial (P1) y volumen inicial (V 1) es igual al producto de presión final (P2) y volumen final (V 2) de gas siempre que la cantidad del gas y la temperatura no cambie.
La presión de una muestra de 1.32 L de gas SO 2 a 0.532 atm se incrementa a 1.231 atm. ¿Calcular el nuevo volumen del gas si la temperatura y la cantidad del gas siguen siendo las mismas?
Solución
Dado: P 1 = 0.532 atm, P 2 = 1.231 atm, V 1 = 1.32 L V 2 =?
Fórmula:\(P_{1} V_{1}=P_{2} V_{2}={k}\), reorganizar para aislar la variable deseada:\(V_{2}=\frac{P_{1} V_{1}}{P_{2}}\).
Conecte los valores en la fórmula rearreglada y calcule:\(V_{2}=\frac{0.532 \mathrm{~atm} \times 1.32 \mathrm{~L}}{1.231 \mathrm{~atm}}=0.570 \mathrm{~L}\)
Un tanque de oxígeno contiene 20.0 L de oxígeno a una presión de 10.0 atm. ¿Cuál es la presión final cuando se libera el gas y ocupa un volumen de 200 L?
Solución
Dado: V 1 = 20.0 L, V 2 = 200 L, P 1 = 10.0 atm P 2 =?
Fórmula:\(P_{1} V_{1}=P_{2} V_{2}={k}\), reorganizar para aislar la variable deseada:\(P_{2}=\frac{P_{1} V_{1}}{V_{2}}\).
Conecte los valores en la fórmula rearreglada y calcule:\(P_{2}=\frac{10.0 \mathrm{~atm} \times 20.0 \mathrm{~L}}{200 \mathrm{~L}}=1.00 \mathrm{~atm}\).
Proceso de respiración
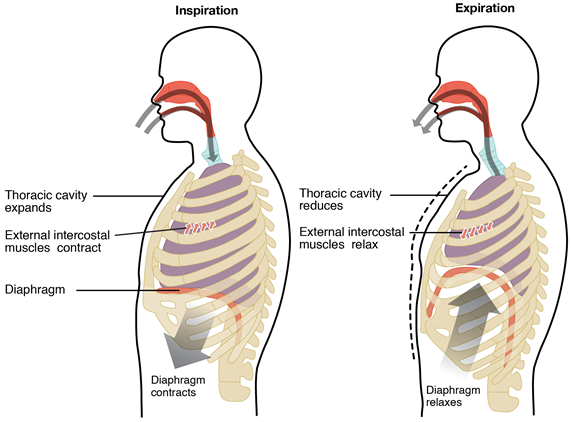
La ley de Boyle explica el mecanismo del proceso de respiración. Los pulmones son estructuras elásticas como globos colocados en la cavidad torácica, como se ilustra en la Fig. 7.2.3. El músculo del diafragma hace un piso flexible y las costillas rodean la cavidad.
Inhalación
El proceso de inhalación o inspiración comienza cuando el diafragma se contrae y se mueve hacia abajo y los músculos de las costillas se contraen, expandiendo la cavidad torácica. El volumen aumenta, la presión del aire disminuye dentro de la cavidad torácica interna y el aire atmosférico fluye hacia los pulmones hasta que la presión en los pulmones es igual a la presión exterior.
Exhalación
El proceso de exhalación o espiración comienza cuando el diafragma se expande y se mueve hacia arriba, y los músculos de las costillas se relajan, contrayendo la cavidad torácica. El volumen disminuye y la presión del aire aumenta dentro de la cavidad torácica que bombea el aire fuera de los pulmones hacia la atmósfera.


