7.8: Ley de Dalton de presión parcial
- Page ID
- 77260
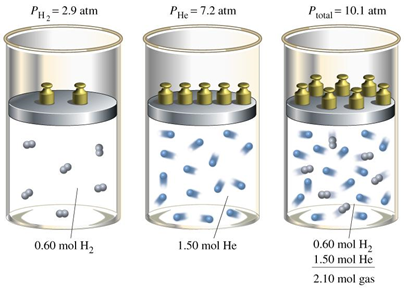
Los cálculos en los ejemplos 2 y 3 de la sección 7.7 prueban que 1.50 mol He en cámara de 5.1 L ejerce una presión de 7.2 atm; 0.6 mol Él en la misma cámara ejerce una presión de 2.9 atm, y una mezcla de los dos en la misma cámara a la misma temperatura ejerce una presión igual a la suma de las presiones que cada uno fracción ejerce si está sola en la cámara, es decir,\(P_{total} = 7.2 { atm} + 2.9 { atm} = 10.1 { atm}\). ¿Y si uno de los gases era hidrógeno y el otro helio? La respuesta es: que los cálculos que utilizan la ley de gas ideal siguen siendo los mismos porque es el número de moléculas, no el tipo de moléculas que están involucradas en los cálculos. Las propiedades de los gases dependen del número de moles de gas\(n\), y no de la naturaleza del gas, como se ilustra en la Fig. 7.8.1.
La presión total de una mezcla de gases equivale a la suma de la presión que ejercería cada gas componente en la mezcla si estuviera presente solo.
La forma matemática de la ley de Dalton es:
\[P_{\text {tatal }}=P_{\text {He }}+P_{\text {exygen }}=9.3 \mathrm{~atm}+2.4 \mathrm{~atm}=11.5 \mathrm{~atm}\nonumber\]
, donde\(P_{1}\),\(P_{2}\),\(P_{3}\) son presiones parciales del gas individual #1, #2, #3 en la mezcla.
El aire atmosférico es una mezcla de nitrógeno, oxígeno, argón, dióxido de carbono, vapores de agua y cantidad de trance de algunos otros gases. La presión atmosférica es la suma de las presiones parciales de los componentes del aire, como se ilustra en la Fig. 7.8.2.

Una muestra de 46 L He y 12 L O 2, ambas a 1.0 atm y 25 o C fueron bombeadas a un tanque de buceo de 5.0 L a 25 o C. Calcular la presión parcial de cada gas y la presión total en el tanque?
Solución
Para Él antes de mezclar:\(V\) = 46 L,\(T\) = 25 o C + 273 = 298 K,\(P\) = 1.0 atm,\(n_{He}\) =? ,\(R=0.08206 \frac{L-\mathrm{atm}}{\mathrm{mol}-K}\)
Fórmula y cálculos:\(n_{\mathrm{He}}=\mathrm{PV} / \mathrm{RT}=\frac{1.0 \mathrm{~atm} \times 46 \mathrm{~L}}{0.08206 \frac{\mathrm{Latm}}{\mathrm{mol}-\mathrm{K}} \times 298 \mathrm{~K}}=1.9 \mathrm{~mol}\)
Para\(O_{2}\) antes de mezclar:\(V\) =12 L,\(T\) =25 o C + 273 =298 K,\(P\) =1.0 atm,\(n_{O_{2}}\) =? ,\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-\mathrm{K}}\)
Fórmula y cálculos:\(n_{H_{2}}=\mathrm{PV} / \mathrm{RT}=\frac{1.0 \mathrm{~atm} \times 12 \mathrm{~L}}{0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}=0.49 \mathrm{~mol}\)
Después de mezclar:\(V\) =5 L,\(T\) =25 o C+273 = 298 K,\(n_{He}\) =1.9 mol,\(n_{O_{2}}\) =0.49 mol,\(R=0.08206 \frac{L-\mathrm{atm}}{\mathrm{mol}-K}\).
Repetido:\(P_{He }\) =? ,\(P_{O_{2}}\) =? , y\(P_{\text {total }}\) =?
Fórmula:\(P_{H e}=\frac{n_{H e} R T}{V}\) =\(\frac{1.9 \mathrm{~mol} \times 0.08206 \frac{L-a t m}{\mathrm{~mol}-K} \times 298 \mathrm{~K}}{5.0 \mathrm{~L}}=9.3 \mathrm{~atm}\),\(P_{O_{2}}=\frac{n_{\text {oxygen } R T}}{V}\) =\(\frac{0.49 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{5.0 \mathrm{~L}}=2.4 \mathrm{~atm}\),
\[P_{\text {total }}=P_{He }+P_{O_{2}}=9.3 \mathrm{~atm}+2.4 \mathrm{~atm}=11.5 \mathrm{~atm.}\nonumber\]
La cámara hiperbárica es una cámara de aire que se encuentra a dos o tres presiones atmosféricas, como se muestra en la Fig. 7.8.3. La solubilidad de los gases aumenta con un aumento de la presión. Un paciente colocado en una cámara hiperbárica tiene una mayor concentración de oxígeno disuelto en la sangre debido a que la presión parcial del oxígeno es de dos a tres veces mayor que en el aire atmosférico. La mayor concentración de oxígeno es tóxica para muchas cepas de bacterias. Por lo tanto, las cámaras hiperbáricas se utilizan para tratar a pacientes quemados, en cirugías, y para tratar algunos cánceres.
Las cámaras hiperbáricas también se utilizan para tratar la intoxicación por monóxido de carbono (CO) debido a que la mayor concentración de oxígeno en la cámara puede desplazar el CO unido con la hemoglobina más rápido que el oxígeno atmosférico. Otro uso de las cámaras hiperbáricas es tratar a los buceadores que sufren de las curvas. Si un buceador asciende demasiado rápido, el nitrógeno disuelto en la sangre hace burbujas en los vasos que bloquean el flujo sanguíneo, una condición llamada curvas. Los buzos que sufren las curvas se colocan en una cámara hiperbárica a alta presión, y luego la presión disminuye lentamente a la presión atmosférica. El nitrógeno se disuelve en la sangre bajo presión más alta y se difunde lentamente a través de los pulmones a medida que la presión disminuye gradualmente.



