7.7: Ley de gas ideal
- Page ID
- 77252
Relaciones combinadas entre presión, volumen, temperatura y cantidad de gases
Las leyes de gas descritas anteriormente dan las siguientes relaciones entre el volumen\(V\)\(P\), la presión, la temperatura en kelvin\(T\) y la cantidad de gas en moles\(n\):
\(V \propto 1 / {P}\), en constante\(T\) y\(n\),
\(V\propto T\), en constante\(P\) y\(n\), y
\(V \propto n\), en constat\(T\) y\(P\).
Las tres proporcionalidades se combinan para dar la siguiente relación de gas ideal:
\[V \propto \frac{nT}{P}\nonumber\]
La proporcionalidad cambia a una ecuación al introducir una constante de proporcionalidad:
\[V=\frac{n R T}{P}\nonumber\], que se reorganiza a\[P V=n R T \nonumber\]
donde\(R\) está la constante de proporcionalidad llamada constante de gas.
La ecuación:\(PV=n R T\) se llama la ley de gas ideal.
El valor de se\(R\) puede calcular por:\(R=\frac{P V}{n T}\), donde\(n\) esta la cantidad de gas en un mol,\(T\) es la temperatura en kelvin,\(P\) es la presión que puede estar en varias unidades, y\(V\) es el volumen que puede estar en varias unidades. El valor de\(R\) en diferentes unidades de\(P\)\(V\), y\(PV\) productos se dan en el Cuadro 1. Si se conocen valores de cualquiera de tres entre los\(P, V, n\), y\(T\) se conocen, el valor del cuarto se puede calcular utilizando la ley de gas ideal.
En estos cálculos, las unidades de\(R\) deben estar de acuerdo con las unidades de\(P, V, n\), y\(T\). Si no están de acuerdo, la unidad dada de\(P, V, n\), y\(T\) deberá ser convertida para convenir con las unidades de\(R\).
|
Valor |
Unidades |
|---|---|
|
0.08206 |
L-ATM/mol-K |
|
8.314 |
J/mol-k |
|
1.987 |
Cal/mol-K |
|
8.314 |
m 3 -Pa/mol-k |
|
62.36 |
L-torr/mol-K |
La ecuación de gas ideal en una forma reorganizada es\(\frac{P V}{n T}=R\) es una constante, eso implica que:
\[\frac{P_{1} V_{1}}{n_{1} T_{1}}=\frac{P_{2} V_{2}}{n_{2} T_{2}}=R\nonumber\]
Si uno o dos parámetros en la ecuación de gas ideal\(\frac{P_{1} V_{1}}{n_{1} T_{1}}=\frac{P_{2} V_{2}}{n_{2} T_{2}}\) son constantes; cancelan, dejando la relación entre los parámetros restantes, e.g.
si\(n\) y\(T\) son constantes:\(P_{1} V_{1}=P_{2} V_{2}\), esa es la ley de Boyle,
si\(P\) y\(n\) son constantes:\(\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}\), esa es la ley de Carlos,
si\(P\) y\(T\) son constantes:\(\frac{V_{1}}{n_{1}}=\frac{V_{2}}{n_{2}}\), esa es la ley de Avogadro,
si\(V\) y\(n\) son constantes:\(\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}\), esa es la ley de Gay Lussac,
si\(V\) y\(T\) son constantes:\(\frac{P_{1}}{n_{1}}=\frac{P_{2}}{n_{2}}\), esa es la relación presión-mol,
y si\(n\) es constante:\(\frac{P_{1} V_{1}}{T_{1}}=\frac{P_{2} V_{2}}{T_{2}}\), eso es ley combinada del gas.
Calcular el volumen de 1.000 mol de un gas en litros (L) a 0.000 o C y 1.000 atm?
Solución:\(n\) Dado=1.000 mol,\(T\) = 0 o C+273.15=273.15 K,\(P\) =1.000 atm, y\(R\) =0.08206 L-atm/mol-K
Solución
\(n\)Dado=1.000 mol,\(T\) = 0 o C+273.15=273.15 K,\(P\) =1.000 atm, y\(R\) =0.08206 L-atm/mol-K
Fórmula:\(PV=nRT\), reorganizar la fórmula a:\(V=\frac{n R T}{P}\).
Enchufe los valores y calcule:\(V=\frac{1.000 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-\mathrm{K}} \times 273.15 \mathrm{~K}}{1.000 \mathrm{~atm}}=22.41 \mathrm{~L}\)
El volumen de 1 mol de un gas ideal es de 22.41 L a 0 o C y 1 atm de presión, como se calcula en el ejemplo anterior
Calcular el volumen de un contenedor que tiene 1.50 mol de gas He a 7.2 atm y 25 o C?
Solución
\(P\)=7.2 atm,\(V\) =? \(n\)=1.50 mol,\(T\) =25 o C} +273=298 K, R=0.08206\(\mathrm{~L}-\mathrm{atm} / \mathrm{mol}-\mathrm{K}\)
Fórmula:\(PV=nRT\), reorganice la fórmula para:\(V=\frac{n R T}{P}\)
Enchufe los valores y calcule:\(V=\frac{1.50 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{7.2 \mathrm{~atm}}=5.1 \mathrm{~L}\)
Calcular la presión en un contenedor de 5.1 L que tiene 0.60 mol de He a 25 o C?
Solución
\(P\)=? ,\(V\) =5.1 L,\(n\) = 0.60 mol,\(T\) =25 o C+273=298 K,\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K}\)
Fórmula:\(PV=nRT\), reorganice la fórmula, conecte los valores y calcule:\(P=\frac{n R T}{V}=\frac{0.60 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L-atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{5.1 \mathrm{~L}}=2.9 \mathrm{~atm}\)
Calcular la presión de 0.60 mol de He en el ejemplo 3 mezclado con 1.50 mol de He en el ejemplo 2 en un recipiente de 5.1 L de volumen a 25 o C? Solución
\(P_{total}\)=? ,\(n_{total}\) = 1.5 mol + 0.60 mol = 2.1 mol,\(V\) = 5.1 L, T = 25 o C + 273 = 298 K, y\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K}\)
Fórmula:\(P_{\text {total }} V=n_{\text {total }} R T\), reorganizar, enchufar los valores y calcular:\(P_{\text {total }}=\frac{n_{\text {total }} R T}{V}=\frac{2.1 \mathrm{~mol} \times 0.08206 \frac{L-a t m}{m o l-K} \times 298 \mathrm{~K}}{5.1 \mathrm{~L}}=10.1 \mathrm{~atm}\)
El\(P_{\text {total }}\) de 2.1 mol He en el ejemplo 4 es igual a\(P\) de 1.50 mol He en el ejemplo 2+\(P\) de 0.6 mol He en el ejemplo 3, es decir, 7.2 atm +2.9 atm =10.1 atm. Este cálculo demuestra que cuando se mezclan los gases, la presión total es la suma de las presiones que ejercerá cada fracción si estuviera sola en ese espacio. Se demuestra mezclando el mismo gas, es decir, Él con Él, pero sigue siendo cierto cuando se mezclan diferentes gases, siempre y cuando todos los gases involucrados obedezcan a la ley del gas ideal.
Volumen molar de gases a temperatura y presión estándar
La temperatura de 0 o C y la presión de 1 atm se denomina temperatura y presión estándar (STP) para los gases.
Actualmente se acepta STP es 0 o C y 1 bar. El volumen molar de un gas ideal a 0 o C y 1 bar es de 22.71 L, pero para la mayoría de los propósitos prácticos, se utiliza la definición más antigua de STP de 0 o C y 1 atm.
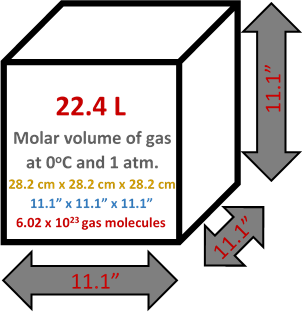
Los cálculos del ejemplo 1 de la sección anterior muestran que el volumen molar de un gas ideal es de 22.41 L en STP. La Fig. 7.7.1 ilustra el volumen molar de un gas ideal en STP.

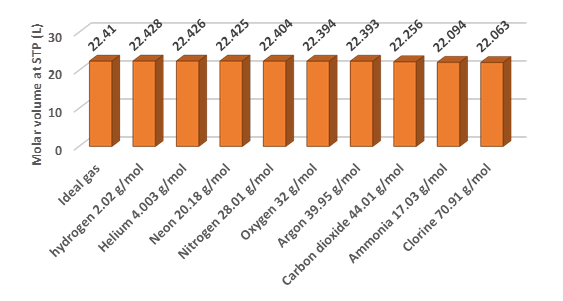
La Fig. 7.7.2 muestra que el volumen molar de los gases reales es muy cercano al del gas ideal. Las pequeñas diferencias entre el volumen molar de gases reales y el gas ideal se deben a que se supone que las moléculas de gas ideales tienen un volumen insignificante e interacciones intermoleculares insignificantes. Las moléculas de gas reales sí tienen cierto volumen y algunas interacciones intermoleculares que provocan desviaciones de los gases reales del comportamiento ideal. Sin embargo, para fines prácticos, los cálculos basados en la ley de gases ideales siguen siendo aplicables para la mayoría de los gases reales en condiciones ambientales.
El volumen molar de gases en STP es una igualdad entre el número de moles y el volumen de gas en STP, es decir:
\[1 \text { mol gas }=22.4 \mathrm{~L} \text { gas at STP }\nonumber\]
La igualdad da dos factores de conversión, es decir,
\[\frac{1 \text { mol gas }}{22.4 \mathrm{~L} \text { gas }}\text {, and }\frac{22.4 \mathrm{~L} \text { gas }}{1 \text { mol gas }} \text {.}\nonumber\]
Los factores de conversión se utilizan para convertir volumen a moles y mol a volumen de gas, respectivamente, a STP.
Calcular el volumen de 64.0 g de oxígeno a STP?
Solución
Dado: masa de oxígeno = 55.2 g. Requerido: volumen del oxígeno =?
Estrategia: Primero convertir los gramos de oxígeno en moles de oxígeno usando recíproco de masa molar como factor de conversión y luego convertir los moles de oxígeno en volumen de oxígeno usando el 2do factor de conversión descrito anteriormente:
\[\text { volume of oxygen }=64.0 \cancel{\mathrm{~g} \text { oxygen }} \times \frac{1 \cancel{\text { mol oxygen }}}{32 \cancel{\mathrm{~g} \text { of oxygen }}} \times \frac{22.41 \mathrm{~L}}{1 \cancel{\text { mol oxygen }}}=44.82 \mathrm{~L} \text { oxygen }\nonumber\]


