1.2: Estados de la materia
- Page ID
- 72989
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
- Describir las fases sólida, líquida y gaseosa de la materia.
El agua puede tomar muchas formas. A bajas temperaturas (abajo\(0^\text{o} \text{C}\)), es un sólido. Cuando a temperaturas “normales” (entre\(0^\text{o} \text{C}\) y\(100^\text{o} \text{C}\)), es un líquido. Mientras que a temperaturas superiores\(100^\text{o} \text{C}\), el agua es un gas (vapor). El estado en el que se encuentra el agua depende de la temperatura. Cada estado (sólido, líquido y gas) tiene su propio conjunto único de propiedades físicas.



La materia generalmente existe en uno de tres estados: sólido, líquido o gas y estos diferentes estados de la materia tienen diferentes propiedades (Tabla\(\PageIndex{1}\)):
- Un gas es un estado de materia en el que los átomos o moléculas tienen suficiente energía para moverse libremente. Las moléculas entran en contacto entre sí sólo cuando chocan aleatoriamente. Las fuerzas entre átomos o moléculas no son lo suficientemente fuertes como para mantenerlos unidos.
- Un líquido es un estado de materia en el que átomos o moléculas están constantemente en contacto pero tienen suficiente energía para mantener posiciones cambiantes entre sí. Las fuerzas entre átomos o moléculas son lo suficientemente fuertes como para mantener las moléculas relativamente juntas pero no lo suficientemente fuertes como para evitar que se muevan más allá de las otras.
- Un sólido es un estado de materia en el que los átomos o moléculas no tienen suficiente energía para moverse. Están constantemente en contacto y en posiciones fijas entre sí. Las fuerzas entre átomos o moléculas son lo suficientemente fuertes como para mantener unidas las moléculas y evitar que se muevan más allá de las otras.
El estado que exhibe una sustancia dada es una propiedad física. Algunas sustancias existen como gases a temperatura ambiente (oxígeno y dióxido de carbono), mientras que otras, como el agua y el mercurio metálico, existen como líquidos. La mayoría de los metales existen como sólidos a temperatura ambiente. Todas las sustancias pueden existir en cualquiera de estos tres estados. La figura\(\PageIndex{2}\) muestra las diferencias entre sólidos, líquidos y gases a nivel molecular. Un sólido tiene un volumen y forma definidos, un líquido tiene un volumen definido pero no una forma definida, y un gas no tiene ni un volumen ni forma definidos (Tabla\(\PageIndex{1}\)).
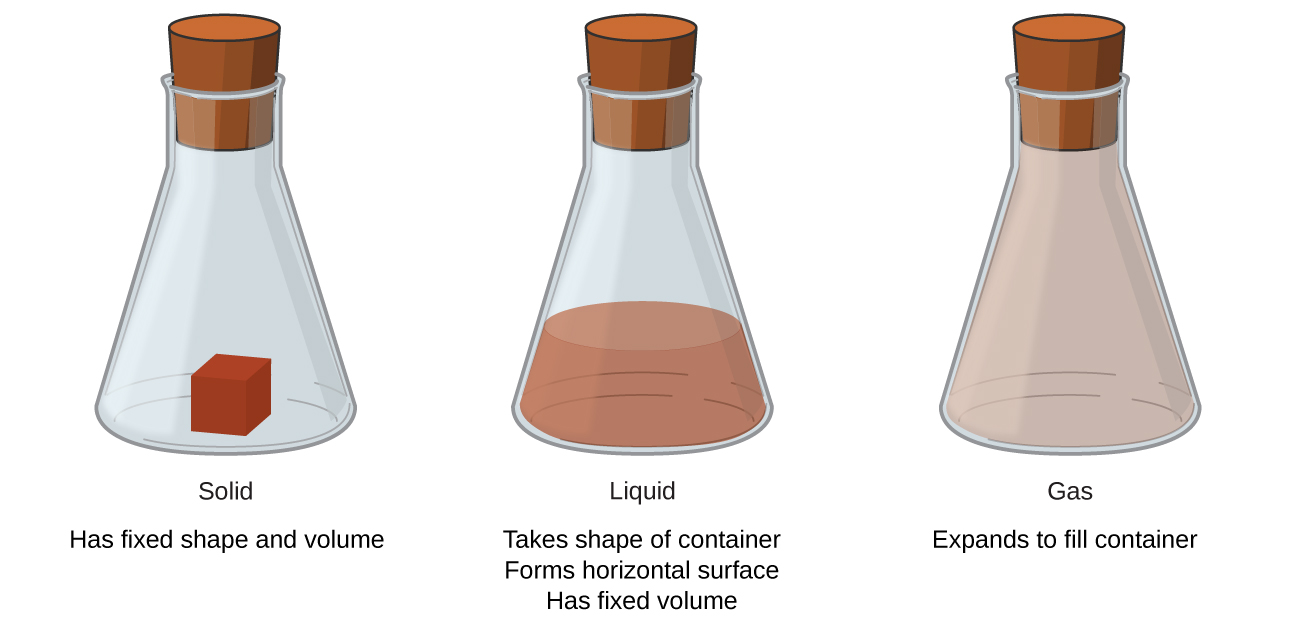
Estas tres descripciones implican cada una que la materia tiene ciertas propiedades físicas cuando se encuentra en estos estados. Un sólido tiene una forma definida y un volumen definido. Los líquidos normalmente tienen un volumen definido pero no una forma definida; toman la forma de sus recipientes. Los gases no tienen una forma definida ni un volumen definido, y se expanden para llenar sus contenedores. Nos encontramos con materia en cada fase todos los días; de hecho, regularmente encontramos agua en las tres fases: hielo (sólido), agua (líquido) y vapor (gas).
| Gas | Líquido | Sólido | |
|---|---|---|---|
|
Forma |
sin forma definida (toma la forma de su contenedor) |
sin forma definida (toma la forma de su contenedor) |
forma definida (rígida) |
|
Volumen |
las partículas se mueven en movimiento aleatorio con poca o ninguna atracción entre sí |
tiene un volumen definido |
volumen definido |
|
Movilidad |
las partículas se mueven en movimiento aleatorio con poca o ninguna atracción entre sí |
las partículas son libres de moverse unas sobre otras, pero aún se sienten atraídas entre sí |
partículas vibran alrededor de ejes fijos |
|
Compresibilidad |
altamente compresible |
débilmente compresible |
débilmente compresible |
Agregar energía a la materia le da a sus átomos o moléculas la capacidad de resistir algunas de las fuerzas que los mantienen unidos. Por ejemplo, calentar el hielo hasta su punto de fusión le da a sus moléculas la energía suficiente para moverse. El hielo se derrite y se convierte en agua líquida. De igual manera, calentar el agua líquida hasta su punto de ebullición le da a sus moléculas la energía suficiente para separarse unas de otras para que ya no tengan contacto. El agua líquida se vaporiza y se convierte en vapor de agua.
El estado de la materia depende de las condiciones externas
La temperatura de los puntos de fusión y ebullición depende de la identidad de la sustancia y de la presión atmosférica. Cada sustancia tiene sus propios puntos de ebullición y fusión que dependen de las propiedades de la sustancia. Como ejemplo, los valores para el agua se dan en la Tabla\(\PageIndex{2}\). Observe cómo el punto de ebullición del agua varía mucho con la presión.
| Altitud (ft) | Presión (atm) | Punto de ebullición (o C) |
|---|---|---|
| -500 | 1.05 | 100.5 |
| 0 | 1.00 | 100 |
| 4000 | 0.892 | 96 |
| 7000 | 0.797 | 93 |
Ejemplo\(\PageIndex{1}\)
El alcohol isopropílico es un compuesto químico incoloro e inflamable con un fuerte olor. Su punto de fusión es de -89°C y su punto de ebullición es de 82.5°C. Es el alcohol isopropílico un sólido, líquido o gas a temperatura ambiente (25°C).
Solución
Dado que la temperatura ambiente (25°C) está por encima del punto de fusión del alcohol isopropílico (-89°C), pero menor que su punto de ebullición (82.5°C), es un líquido a temperatura ambiente.
Ejercicio\(\PageIndex{1}\)
El freón-12 se utiliza como refrigerante y propelente en aerosol. Su punto de fusión es -157.7°C y su punto de ebullición es de -29.8 °C. Es el alcohol isopropílico un sólido, líquido o gas a temperatura ambiente (25°C).
- Responder
-
Freón-12 es un gas a temperatura ambiente
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

