2.1: La teoría atómica y la estructura de los átomos
- Page ID
- 73335
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Indicar la teoría atómica moderna.
- Describir cómo se construyen los átomos.
La pieza más pequeña de un elemento que mantiene la identidad de ese elemento se llama átomo. Los átomos individuales son extremadamente pequeños. Se necesitarían unos cincuenta millones de átomos seguidos para hacer una línea de 1 cm de largo. El periodo al final de una oración impresa tiene varios millones de átomos en ella. Los átomos son tan pequeños que es difícil creer que toda la materia esté hecha de átomos, pero lo es.
La teoría atómica moderna, propuesta alrededor de 1803 por el químico inglés John Dalton, es un concepto fundamental que establece que todos los elementos están compuestos por átomos. Anteriormente, definimos un átomo como la parte más pequeña de un elemento que mantiene la identidad de ese elemento. Los átomos individuales son extremadamente pequeños; incluso el átomo más grande tiene un diámetro aproximado de sólo 5.4 × 10 −10 m. Con ese tamaño, toma más de 18 millones de estos átomos, alineados uno al lado del otro, para igualar el ancho de tu dedo meñique (aproximadamente 1 cm).
Dalton estudió los pesos de diversos elementos y compuestos. Se percató de que la materia siempre se combina en proporciones fijas basadas en el peso, o volumen en el caso de los gases. Los compuestos químicos siempre contienen la misma proporción de elementos en masa, independientemente de la cantidad, lo que proporcionó un mayor apoyo a la ley de Proust de proporciones definidas. Dalton también observó que podría haber más de una combinación de dos elementos.
A partir de sus experimentos y observaciones, así como del trabajo de pares de su tiempo, Dalton propuso una nueva teoría del átomo. Esto más tarde se conoció como la teoría atómica de Dalton. Los principios generales de esta teoría fueron los siguientes:
- Toda la materia está compuesta por partículas extremadamente pequeñas llamadas átomos.
- Los átomos de un elemento dado son idénticos en tamaño, masa y otras propiedades. Los átomos de diferentes elementos difieren en tamaño, masa y otras propiedades.
- Los átomos no pueden ser subdivididos, creados o destruidos.
- Los átomos de diferentes elementos pueden combinarse en simples proporciones de números enteros para formar compuestos químicos.
- En las reacciones químicas, los átomos se combinan, separan o reordenan.
La teoría atómica de Dalton ha sido ampliamente aceptada por la comunidad científica, con la excepción de tres cambios. Sabemos ahora que (1) un átomo puede subdividirse aún más, (2) todos los átomos de un elemento no son idénticos en masa, y (3) usando técnicas de fisión y fusión nuclear, podemos crear o destruir átomos cambiándolos en otros átomos.
Estos conceptos forman la base de la química. Aunque la palabra átomo proviene de una palabra griega que significa “indivisible”, ahora entendemos que los átomos mismos están compuestos por partes más pequeñas llamadas partículas subatómicas. La primera parte que se descubrió fue el electrón, una diminuta partícula subatómica con carga negativa. A menudo se representa como e −, con el superíndice correcto que muestra la carga negativa. Posteriormente, se descubrieron dos partículas más grandes. El protón, una partícula subatómica con carga positiva. es una partícula subatómica más masiva (pero aún diminuta) con una carga positiva, representada como p +. El neutrón es una partícula subatómica con aproximadamente la misma masa que un protón pero sin carga. Se representa como n o n 0. Ahora sabemos que todos los átomos de todos los elementos están compuestos por electrones, protones y (con una excepción) neutrones. La tabla\(\PageIndex{1}\) resume las propiedades de estas tres partículas subatómicas.
| Nombre | Símbolo | Masa (aprox.; g) | Masa (aprox.; amu) | Cargar |
|---|---|---|---|---|
| Protón | p + | 1.673 × 10 −24 | 1.0073 | +1 |
| Neutrón | n, n 0 | 1.675 × 10 −24 | 1.0087 | ninguno |
| Electron | e − | 9.109 × 10 −28 | 5.486 × 10 −4 | —1 |
Los átomos y las partículas subatómicas son tan pequeños que no tiene mucho sentido medir sus masas en gramos. Una unidad más útil para medir la masa atómica es la unidad de masa atómica (\(\text{amu}\)), donde 1 amu = 1.660539 × 10 −24 g o una doceava parte de la masa de un átomo de carbono-12. Como puede ver en la tabla anterior, la masa de 1 protón y 1 neutrón son cada una de 1 amu en este sistema. Carbon-12 contiene seis protones y seis neutrones y se le asigna una masa de exactamente 12 amu.

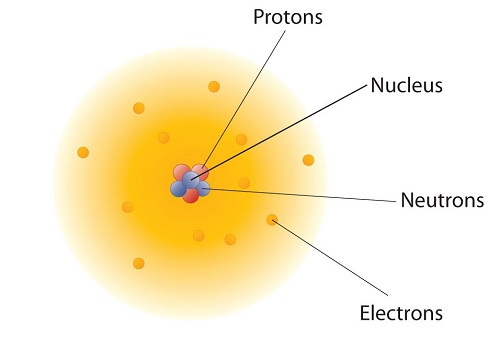
¿Cómo están dispuestas estas partículas subatómicas en átomos? No están dispuestos al azar. Los experimentos de Ernest Rutherford en Inglaterra en la década de 1910 apuntaron a un modelo nuclear con at oms que tiene los protones y neutrones en un núcleo central con los electrones en órbita alrededor del núcleo. Los protones y neutrones relativamente masivos se recogen en el centro de un átomo, en una región llamada núcleo del átomo (núcleos plurales). Los electrones están fuera del núcleo y pasan su tiempo orbitando en el espacio alrededor del núcleo. (Figura\(\PageIndex{2}\)). Debido a que los protones y neutrones son tan masivos comparados con los electrones\(\PageIndex{1}\), Tabla, casi toda la masa de un átomo está contenida en el núcleo.
La evidencia de los átomos es tan grande que pocos dudan de su existencia. De hecho, los átomos individuales ahora se observan rutinariamente con tecnologías de última generación. Además, incluso se pueden utilizar para hacer imágenes bonitas o como demuestran las investigaciones de IBM en Video\(\PageIndex{1}\), el control de átomos individuales se puede utilizar para crear animaciones.
Video\(\PageIndex{1}\): Un niño y su átomo - La película más pequeña del mundo. A Boy and His Atom es un cortometraje animado stop-motion del 2012 lanzado por IBM Research. La película cuenta la historia de un niño y un átomo descarriado que se encuentran y se hacen amigos. Representa a un niño jugando con un átomo que toma diversas formas. Se hizo moviendo moléculas de monóxido de carbono vistas con un microscopio de túnel de barrido, un dispositivo que las magnifica 100 millones de veces. Estas moléculas se movieron para crear imágenes, las cuales luego se guardaron como fotogramas individuales para hacer la película.
Claves para llevar
- La química se basa en la teoría atómica moderna, que establece que toda la materia está compuesta por átomos.
- Los átomos mismos están compuestos por protones, neutrones y electrones.
- Cada elemento tiene su propio número atómico, que es igual al número de protones en su núcleo.

