5.1: Ecuaciones Químicas
- Page ID
- 73576
Objetivos de aprendizaje
- Definir reacción química.
- Comprender la Ley de Conservación de la Materia
El agua (H 2 O) está compuesta por hidrógeno y oxígeno. Supongamos que imaginamos un proceso en el que tomamos algo de hidrógeno elemental (H 2) y oxígeno elemental (O 2) y los dejamos reaccionar para hacer agua. El comunicado
“hidrógeno y oxígeno reaccionan para hacer agua”
es una forma de representar ese proceso, que se llama reacción química. La figura\(\PageIndex{1}\) muestra un ejemplo bastante dramático de esta misma reacción.

Para simplificar la escritura de reacciones, utilizamos fórmulas en lugar de nombres cuando describimos una reacción. También podemos usar símbolos para representar otras palabras en la reacción. Un signo más conecta las sustancias iniciales (y las sustancias finales, si hay más de una), y una flecha (→) representa el cambio químico:
\[\ce{H_2 + O_2 \rightarrow H_2O} \label{Eq1}\]
Esta afirmación es un ejemplo de una ecuación química, una forma abreviada de usar símbolos para representar un cambio químico. Las sustancias en el lado izquierdo de la flecha se llaman reactivos, y las sustancias en el lado derecho de la flecha se llaman productos. No es raro incluir un marcador de fase con cada fórmula— (s) para sólido, (l) para líquido, (g) para gas y (ac) para una sustancia disuelta en agua, también conocida como solución acuosa. Si incluimos etiquetas de fase para los reactivos y productos, en condiciones ambientales normales, la reacción sería la siguiente:
\[\ce{H2(g) + O2(g) \rightarrow H2O (ℓ)} \label{Eq2}\]
Esta ecuación aún no está completa porque no satisface la ley de conservación de la materia. Contar el número de átomos de cada elemento a cada lado de la flecha. En el lado reactivo, hay dos átomos de H y dos átomos de O; en el lado del producto, hay dos átomos de H y solo un átomo de oxígeno. La ecuación no está equilibrada porque el número de átomos de oxígeno en cada lado no es el mismo (Figura\(\PageIndex{2}\)).
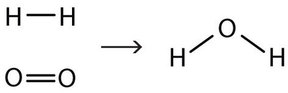
Para que esta ecuación química se ajuste a la ley de conservación de la materia, debemos revisar las cantidades de los reactivos y los productos según sea necesario para obtener el mismo número de átomos de un elemento dado en cada lado. Debido a que cada sustancia tiene una fórmula química característica, no podemos cambiar las fórmulas químicas de las sustancias individuales. Por ejemplo, no podemos cambiar la fórmula del oxígeno elemental a O. Sin embargo, podemos suponer que pueden estar involucrados diferentes números de moléculas reaccionantes o moléculas de producto. Por ejemplo, tal vez se producen dos moléculas de agua, no solo una:
\[\ce{H2(g) + O2 (g) \rightarrow 2H2O (ℓ)} \label{Eq3}\]
El 2 que precede a la fórmula para el agua se llama coeficiente. Implica que se forman dos moléculas de agua. Ahora hay dos átomos de oxígeno a cada lado de la ecuación.
Este punto es tan importante que debemos repetirlo. ¡No se puede cambiar la fórmula de una sustancia química para equilibrar una reacción química! Debe usar la fórmula química adecuada de la sustancia.
Desafortunadamente, al insertar el coeficiente 2 frente a la fórmula para el agua, también hemos cambiado el número de átomos de hidrógeno en el lado del producto también. Como resultado, ya no tenemos el mismo número de átomos de hidrógeno en cada lado. Esto se puede fijar fácilmente, sin embargo, poniendo un coeficiente de 2 delante del reactivo de hidrógeno diatómico:
\[\ce{2H2(g) + O2(g) \rightarrow 2H2O (ℓ)} \label{Eq4}\]
Ahora tenemos cuatro átomos de hidrógeno y dos átomos de oxígeno a cada lado de la ecuación. La ley de conservación de la materia se satisface porque ahora tenemos el mismo número de átomos de cada elemento en los reactivos y en los productos. Decimos que la reacción ahora está equilibrada (Figura\(\PageIndex{3}\)). Nota: El oxígeno diatómico tiene un coeficiente de 1, el cual normalmente no se escribe sino que se asume en ecuaciones químicas balanceadas.
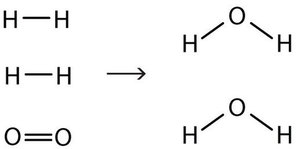
Las ecuaciones químicas adecuadas deben ser equilibradas. Escribir reacciones equilibradas es una manera química de reconocer la ley de conservación de la materia.
Ejemplo\(\PageIndex{1}\)
¿Cada ecuación química está equilibrada?
- 2Na (s) + O 2 (g) → 2Na 2 O (s)
- CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (l)
- AgnO 3 (aq) + 2KCl (aq) → AgCl (s) + KNO 3 (aq)
Solución
- Al contar, encontramos dos átomos de sodio y dos átomos de oxígeno en los reactivos y cuatro átomos de sodio y dos átomos de oxígeno en los productos. Esta ecuación no está equilibrada.
- Los reactivos tienen un átomo de carbono, cuatro átomos de hidrógeno y cuatro átomos de oxígeno. Los productos tienen un átomo de carbono, cuatro átomos de hidrógeno y cuatro átomos de oxígeno. Esta ecuación está equilibrada.
- Los reactivos tienen un átomo de plata, un átomo de nitrógeno, tres átomos de oxígeno, dos átomos de potasio y dos átomos de cloro. Los productos tienen un átomo de plata, un átomo de cloro, un átomo de potasio, un átomo de nitrógeno y tres átomos de oxígeno. Debido a que hay diferentes números de átomos de cloro y potasio, esta ecuación no está equilibrada.
Ejercicio\(\PageIndex{1}\)
¿Cada ecuación química está equilibrada?
- \(2Hg_{(ℓ)} + O_{2(g)} \rightarrow Hg_2O_{2(s)}\)
- \(C_2H_{4(g)} + 2O_{2(g)} \rightarrow 2CO_{2(g)} + 2H_2O_{(ℓ)}\)
- \(Mg(NO_3)_{2(s)} + 2Li_{(s)} \rightarrow Mg_{(s)} + 2LiNO_{3(s)}\).
- Respuesta a:
-
balanceado
- Respuesta b:
-
O no está equilibrado; los 4 átomos de oxígeno de la izquierda no se equilibra con los 6 átomos de oxígeno de la derecha
- Respuesta c:
-
balanceado

