5.5: Reacciones Redox
- Page ID
- 73580
- Identificar una reacción química como reacción de oxidación-reducción.
Cuando el zinc metálico se sumerge en una cantidad acuosa\(\ce{HCl}\), se produce la siguiente reacción (Figura\(\PageIndex{1}\)):
\[\ce{Zn (s) + 2HCl (aq) → H2 (g) + ZnCl2(aq)} \label{eq:1} \]
Este es un ejemplo de lo que a veces se llama una sola reacción de reemplazo porque\(\ce{Zn}\) reemplaza\(\ce{H}\) en combinación con\(\ce{Cl}\).

Debido a que algunas de las sustancias en esta reacción son acuosas, podemos separarlas en iones:
\[\ce{Zn (s) + 2H^{+} (aq) + 2Cl^{−} (aq) → H2(g) + Zn^{2+} (aq) + 2Cl^{−} (aq)} \nonumber \]
Visto de esta manera, la reacción neta parece ser una transferencia de carga entre los átomos de zinc e hidrógeno. (No hay cambio neto experimentado por el ion cloruro.) De hecho, los electrones se están transfiriendo de los átomos de zinc a los átomos de hidrógeno (que finalmente hacen una molécula de hidrógeno diatómico), cambiando las cargas en ambos elementos.
Para entender las reacciones de transferencia de electrones como la que existe entre el metal zinc y los iones hidrógeno, los químicos los separan en dos partes: una parte se centra en la pérdida de electrones y una parte se centra en la ganancia de electrones. La pérdida de electrones se llama oxidación. La ganancia de electrones se llama reducción. Debido a que cualquier pérdida de electrones por una sustancia debe ir acompañada de una ganancia en electrones por otra cosa, la oxidación y la reducción siempre ocurren juntas. Como tal, las reacciones de transferencia de electrones también se denominan reacciones de oxidación-reducción, o simplemente reacciones redox. El átomo que pierde electrones se oxida, y el átomo que gana electrones se reduce. Además, debido a que podemos pensar que las especies que se oxidan causan la reducción, la especie que se oxida se llama agente reductor, y la especie que se reduce se llama agente oxidante.
Debido a que las baterías se utilizan como fuentes de electricidad (es decir, de electrones), todas las baterías se basan en reacciones redox.
Aunque las dos reacciones ocurren juntas, puede ser útil escribir las reacciones de oxidación y reducción por separado como medias reacciones. En medias reacciones, incluimos solo el reactivo que se oxida o reduce, las especies de producto correspondientes, cualquier otra especie necesaria para equilibrar la media reacción y los electrones que se transfieren. Los electrones que se pierden se escriben como productos; los electrones que se ganan se escriben como reactivos. Por ejemplo, en nuestra ecuación anterior, ahora escrita sin los iones cloruro,
\[\ce{Zn (s) + 2H^{+} (aq) → Zn^{2+}(aq) + H2(g)} \nonumber \]
los átomos de zinc se oxidan a Zn 2 +. La media reacción para la reacción de oxidación, omitiendo las marcas de fase, es la siguiente:
\[\ce{Zn → Zn^{2+} + 2e^{−}} \nonumber \]
Esta media reacción se equilibra en términos del número de átomos de zinc, y también muestra los dos electrones que se necesitan como productos para dar cuenta de que el átomo de zinc pierde dos cargas negativas para convertirse en un ion 2+. Con medias reacciones, hay un elemento más para equilibrar: la carga general en cada lado de la reacción. Si revisas cada lado de esta reacción, notarás que ambos lados tienen una carga neta cero.
El hidrógeno se reduce en la reacción. La media reacción de reducción equilibrada es la siguiente:
\[\ce{2H^{+} + 2e^{−} → H2} \nonumber \]
Hay dos átomos de hidrógeno en cada lado, y los dos electrones escritos como reactivos sirven para neutralizar la carga 2+ en los iones de hidrógeno reaccionantes. Nuevamente, la carga general en ambos lados es cero.
La reacción global es simplemente la combinación de las dos medias reacciones y se muestra al sumarlas juntas.
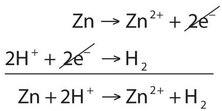
Debido a que tenemos dos electrones a cada lado de la ecuación, pueden ser cancelados. Este es el criterio clave para una reacción redox equilibrada: los electrones tienen que cancelar exactamente. Si verificamos la carga en ambos lados de la ecuación, vemos que son los mismos—2+. (En realidad, esta carga positiva se equilibra con las cargas negativas de los iones cloruro, que no se incluyen en esta reacción porque el cloro no participa en la transferencia de carga).
Las reacciones redox a menudo se equilibran equilibrando cada media reacción individual y luego combinando las dos medias reacciones equilibradas. A veces una media reacción debe tener todos sus coeficientes multiplicados por algún número entero para que todos los electrones se cancelen. El siguiente ejemplo demuestra este proceso.
Escribe y equilibra la reacción redox que tiene iones plata y aluminio metal como reactivos e iones plata metal y aluminio como productos. Identificar la sustancia oxidada, sustancia reducida, agente reductor y agente reductor.
Solución
Comenzamos usando símbolos de los elementos e iones para representar la reacción:
\[\ce{Ag^{+} + Al → Ag + Al^{3+}} \nonumber \]
La ecuación se ve equilibrada tal como está escrita. Sin embargo, cuando comparamos las cargas generales en cada lado de la ecuación, encontramos una carga de +1 a la izquierda pero una carga de +3 a la derecha. Esta ecuación no está debidamente equilibrada. Para equilibrarlo, escribamos las dos medias reacciones. Los iones de plata se reducen, y se necesita un electrón para cambiar Ag + a Ag:
Media reacción de reducción:\[\ce{Ag^{+} + e^{−} → Ag} \nonumber \]
El aluminio se oxida, perdiendo tres electrones para cambiar de Al a Al 3 +:
Semi-reacción de oxidación:\[\ce{Al → Al^{3+} + 3e^{−}} \nonumber \]
Para combinar estas dos medias reacciones y cancelar todos los electrones, necesitamos multiplicar la reacción de reducción de plata por 3:
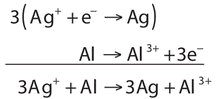
Ahora la ecuación está equilibrada, no sólo en términos de elementos sino también en términos de carga.
- La sustancia oxidada es el reactivo que había sufrido oxidación: Al
- La sustancia reducida es el reactivo que había sufrido reducción: Ag +
- El agente reductor es el mismo que la sustancia oxidada: Al
- El agente oxidante es el mismo que la sustancia reducida: Ag +
Escribe y equilibra la reacción redox que tiene iones calcio y potasio metal como reactivos y iones calcio metal y potasio como productos. Identificar la sustancia oxidada, sustancia reducida, agente reductor y agente reductor.
- Contestar
-
Reducción: Ca 2 + + 2e − → Ca
Oxidación: 2 (K → K + + e −)
Combinado: Ca 2 + + 2K → Ca + 2K +
- La sustancia oxidada es el reactivo que había sufrido oxidación: K
- La sustancia reducida es el reactivo que había sufrido reducción: Ca 2 +
- El agente reductor es el mismo que la sustancia oxidada: K
- El agente oxidante es el mismo que la sustancia reducida: Ca 2 +
El potasio se ha utilizado como agente reductor para obtener diversos metales en su forma elemental.
Todas las baterías utilizan reacciones redox para suministrar electricidad porque la electricidad es básicamente una corriente de electrones que se transfieren de una sustancia a otra. Los marcapasos, dispositivos implantados quirúrgicamente para regular el latido cardíaco de una persona, funcionan con pequeñas baterías, por lo que el correcto funcionamiento de un marcapasos depende de una reacción redox.
Los marcapasos solían ser alimentados por baterías NiCad, en las que el níquel y el cadmio (de ahí el nombre de la batería) reaccionan con el agua de acuerdo con esta reacción redox:
\[\ce{Cd(s) + 2NiOOH(s) + 2H2O(ℓ) → Cd(OH)2(s) + 2Ni(OH) 2(s)} \nonumber \]
El cadmio se oxida, mientras que los átomos de níquel en NiOOH se reducen. A excepción del agua, todas las sustancias en esta reacción son sólidas, lo que permite que las baterías de NiCad se recarguen cientos de veces antes de que dejen de funcionar. Desafortunadamente, las baterías NiCad son baterías bastante pesadas para ser transportadas en un marcapasos. Hoy en día, en su lugar se utiliza la batería de litio/yodo más ligera. El yodo se disuelve en un soporte polimérico sólido, y la reacción redox global es la siguiente:
\[\ce{2Li(s) + I2(s) → 2LiI (s)} \nonumber \]
El litio se oxida y se reduce el yodo. Si bien la batería de litio/yodo no se puede recargar, una de sus ventajas es que dura hasta 10 años. Así, una persona con marcapasos no tiene que preocuparse por la recarga periódica; aproximadamente una vez por década una persona requiere cirugía menor para reemplazar el marcapasos/unidad de batería. Las baterías de litio/yodo también se utilizan para alimentar calculadoras y relojes.

La oxidación y reducción también se pueden definir en términos de cambios en la composición. El significado original de oxidación era “agregar oxígeno”, por lo que cuando se agrega oxígeno a una molécula, la molécula se está oxidando. Lo contrario es cierto para la reducción: si una molécula pierde átomos de oxígeno, la molécula se está reduciendo. Por ejemplo, la molécula de acetaldehído (\(\ce{CH3CHO}\)) toma un átomo de oxígeno para convertirse en ácido acético (\(\ce{CH3COOH}\)).
\[\ce{2CH3CHO + O2 → 2CH_3COOH} \nonumber \]
Así, el acetaldehído está siendo oxidado.
De igual manera, la reducción y oxidación pueden definirse en términos de ganancia o pérdida de átomos de hidrógeno. Si una molécula agrega átomos de hidrógeno, se está reduciendo. Si una molécula pierde átomos de hidrógeno, la molécula está siendo oxidada. Por ejemplo, en la conversión de acetaldehído en etanol (\(\ce{CH3CH2OH}\)), se agregan átomos de hidrógeno al acetaldehído, por lo que el acetaldehído se está reduciendo:
\[\ce{CH3CHO + H2 → CH3CH2OH} \nonumber \]
| Proceso | Cambio en el oxígeno (algunas reacciones) | Cambio en el hidrógeno (algunas reacciones) |
|---|---|---|
| Oxidación | ganancia | perder |
| Reducción | perder | ganancia |
En cada conversión, indicar si se está produciendo oxidación o reducción.
- N 2 → NH 3
- CH 3 CH 2 OHCH 3 → CH 3 COCH 3
- HCHO → HCOOH
Solución
- Se está agregando hidrógeno a la molécula reaccionante original, por lo que se está produciendo una reducción.
- El hidrógeno se está eliminando de la molécula reaccionante original, por lo que se está produciendo la oxidación.
- Se está agregando oxígeno a la molécula reaccionante original, por lo que se está produciendo la oxidación.
En cada conversión, indicar si se está produciendo oxidación o reducción.
- CH 4 → CO 2 + H 2 O
- NO 2 → N 2
- CH 2 =CH 2 → CH 3 CH 3
- Respuesta a:
-
Se está agregando oxígeno. La oxidación está ocurriendo.
- Respuesta b:
-
Se está eliminando el oxígeno. La reducción está ocurriendo.
- Respuesta a:
-
Se está agregando hidrógeno. La reducción está ocurriendo.
Llave para llevar
Las reacciones químicas en las que se transfieren electrones se denominan reacciones de oxidación-reducción, o redox. La oxidación es la pérdida de electrones. La reducción es la ganancia de electrones. La oxidación y la reducción siempre ocurren juntas, aunque pueden escribirse como ecuaciones químicas separadas.

