9.6: Unidades de Concentración
- Page ID
- 73250
- Calcular la concentración porcentual (m/m, v/v, m/v), ppm y ppb.
- Calcular la molaridad de una solución.
- Use unidades de concentración para calcular la cantidad de soluto en una solución.
- Utilizar molaridad para determinar cantidades en reacciones químicas.
Porcentaje de Concentración
Existen varias formas de expresar la concentración de una solución mediante el uso de un porcentaje. El porcentaje masa/masa (% m/m) se define como la masa de un soluto dividida por la masa de una solución por 100:
\[\mathrm{\% \:m/m = \dfrac{mass\: of\: solute}{mass\: of\: solution}\times100\%} \nonumber \]
Si puedes medir las masas del soluto y la solución, determinar el porcentaje masa/masa es fácil. Cada masa debe expresarse en las mismas unidades para determinar la concentración adecuada.
Una solución salina con una masa de 355 g tiene 36.5 g de NaCl disueltos en ella. ¿Cuál es la concentración de porcentaje masa/masa de la solución?
Solución
Podemos sustituir las cantidades dadas en la ecuación por porcentaje masa/masa:
\(\mathrm{\%\: m/m=\dfrac{36.5\: g}{355\: g}\times100\%=10.3\%}\)
Una solución de dextrosa (también llamada D-glucosa, C 6 H 12 O 6) con una masa de 2.00 × 10 2 g tiene 15.8 g de dextrosa disueltos en ella. ¿Cuál es la concentración de porcentaje masa/masa de la solución?
- Contestar
-
7.90%
Para gases y líquidos, los volúmenes son relativamente fáciles de medir, por lo que la concentración de un líquido o una solución gaseosa se puede expresar como un porcentaje volumen/volumen (% v/v): el volumen de un soluto dividido por el volumen de una solución por 100:
\[\mathrm{\%\: v/v = \dfrac{volume\: of\: solute}{volume\: of\: solution}\times100\%} \nonumber \]
Nuevamente, las unidades del soluto y la solución deben ser las mismas. Una unidad de concentración híbrida, por ciento masa/volumen (% m/v), se usa comúnmente para fluidos intravenosos (IV) (Figura\(\PageIndex{1}\)). Se define como la masa en gramos de un soluto, dividida por volumen en mililitros de solución por 100:
\[\mathrm{\%\: m/v = \dfrac{mass\: of\: solute\: (g)}{volume\: of\: solution\: (mL)}\times100\%} \nonumber \]
Uso de la concentración porcentual en los cálculos
La concentración porcentual se puede utilizar para producir un factor de conversión entre la cantidad de soluto y la cantidad de solución. Como tal, las concentraciones pueden ser útiles en una variedad de problemas estequiométricos como se discute en el Capítulo 6. En muchos casos, lo mejor es utilizar la definición original de la unidad de concentración; es esa definición la que proporciona el factor de conversión.
Como ejemplo, si la concentración dada es 5% v/v de solución de alcohol, esto significa que hay 5 mL de alcohol disueltos en cada 100 mL de solución.
5 mL de alcohol = 100 mL de solución
Los dos posibles factores de conversión se escriben de la siguiente manera:
\(\mathrm{\dfrac{5\: mL\: alcohol}{100\: mL\: solution}}\)o \(\mathrm{\dfrac{100\: mL\: solution}{5\: mL\: alcohol}}\)
Use el primer factor de conversión para convertir de una cantidad dada de solución a cantidad de soluto. El segundo factor de conversión se utiliza para convertir de una cantidad dada de soluto a cantidad de solución. Dadas dos cantidades cualesquiera en cualquier composición porcentual, se puede calcular la tercera cantidad, como lo ilustra el siguiente ejemplo.
Una muestra de 45.0% v/v de solución de etanol (C 2 H 5 OH) en agua tiene un volumen de 115 mL. ¿Qué volumen de soluto de etanol contiene la muestra?
Solución
Una concentración porcentual es simplemente el número de partes de soluto por cada 100 partes de solución. Así, la concentración porcentual de 45.0% v/v implica lo siguiente:
\(\mathrm{45.0\%\: v/v \rightarrow \dfrac{45\: mL\: C_2H_5OH}{100\: mL\: solution}}\)
Es decir, hay 45 mL de C 2 H 5 OH por cada 100 mL de solución. Podemos usar esta fracción como factor de conversión para determinar la cantidad de C 2 H 5 OH en 115 mL de solución:
\(\mathrm{115\: mL\: solution\times\dfrac{45\: mL\: C_2H_5OH}{100\: mL\: solution}=51.8\: mL\: C_2H_5OH}\)
¿Qué volumen de una solución 12.75% m/v de glucosa (C 6 H 12 O 6) en agua se necesita para obtener 50.0 g de C 6 H 12 O 6?
- Contestar
-
\(\mathrm{50.0\: g\: C_6H_12O_6\times\dfrac{100\: mL\: solution}{12.75\: g\: C_6H_12O_6}=392\: mL\: solution}\)
Una solución salina IV normal contiene 9.0 g de NaCl en cada litro de solución. ¿Cuál es el porcentaje masa/volumen de la solución salina normal?
Solución
Podemos usar la definición de porcentaje masa/volumen, pero primero tenemos que expresar el volumen en unidades mililitros:
1 L = 1,000 mL
Debido a que esta es una relación exacta, no afecta las cifras significativas de nuestro resultado.
\(\mathrm{\%\: m/v = \dfrac{9.0\: g\: NaCl}{1,000\: mL\: solution}\times100\%=0.90\%\: m/v}\)
El blanqueador de cloro que podrías encontrar en tu cuarto de lavado suele estar compuesto por 27.0 g de hipoclorito de sodio (NaOCl), disuelto para hacer 500.0 ml de solución. ¿Cuál es el porcentaje masa/volumen de la lejía?
- Contestar
-
\(\mathrm{\%\: m/v = \dfrac{27.0\: g\: NaOCl}{500.0\: mL\: solution}\times100\%=5.40\%\: m/v}\)
Partes por millón (ppm) y partes por mil millones (ppb)
Además de las unidades porcentuales, las unidades para expresar la concentración de soluciones extremadamente diluidas son partes por millón (ppm) y partes por mil millones (ppb). Ambas unidades están basadas en masa y se definen de la siguiente manera:
\[\mathrm{ppm=\dfrac{mass\: of\: solute}{mass\: of\: solution}\times1,000,000} \nonumber \]
\[\mathrm{ppb=\dfrac{mass\: of\: solute}{mass\: of\: solution}\times1,000,000,000} \nonumber \]
Similar a las partes por millón y partes por mil millones, las unidades relacionadas incluyen partes por mil (ppth) y partes por billón (ppt).
Las concentraciones de oligoelementos en el cuerpo —elementos que están presentes en concentraciones extremadamente bajas pero que no obstante son necesarios para la vida— se expresan comúnmente en partes por millón o partes por mil millones. También se describen las concentraciones de venenos y contaminantes en estas unidades. Por ejemplo, el cobalto está presente en el cuerpo a una concentración de 21 ppb, mientras que el Departamento de Agricultura del Estado de Oregón limita la concentración de arsénico en fertilizantes a 9 ppm.
En soluciones acuosas, 1 ppm es esencialmente igual a 1 mg/L, y 1 ppb es equivalente a 1 µg/L.
Si la concentración de cobalto en un cuerpo humano es de 21 ppb, ¿qué masa en gramos de Co está presente en un cuerpo que tiene una masa de 70.0 kg?
Solución
Una concentración de 21 ppb significa “21 g de soluto por 1,000,000,000 g de solución”. Escrito como factor de conversión, esta concentración de Co es la siguiente:
\(\mathrm{21\: ppb\: Co \rightarrow \dfrac{21\: g\: Co}{1,000,000,000\: g\: solution}}\)
Podemos usar esto como factor de conversión, pero primero debemos convertir 70.0 kg a unidades de gramo:
\(\mathrm{70.0\: kg\times\dfrac{1,000\: g}{1\: kg}=7.00\times10^4\: g}\)
Ahora determinamos la cantidad de Co:
\(\mathrm{7.00\times10^4\: g\: solution\times\dfrac{21\: g\: Co}{1,000,000,000\: g\: solution}=0.0015\: g\: Co}\)
Esto es sólo 1.5 mg.
Un cuerpo de 85 kg contiene 0.012 g de Ni. ¿Cuál es la concentración de Ni en partes por millón?
- Contestar
-
0.14 ppm
Concentración Mole/Volumen: Molaridad
Otra forma de expresar la concentración es dar el número de moles de soluto por unidad de volumen de solución. Dichas unidades de concentración son útiles para discutir reacciones químicas en las que un soluto es un producto o un reactivo. La masa molar se puede usar entonces como factor de conversión para convertir cantidades en moles a cantidades en gramos.
La molaridad (M) se define como el número de moles de un soluto disuelto por litro de solución:
\[\mathrm{molarity=\dfrac{number\: of\: moles\: of\: solute}{number\: of\: liters\: of\: solution}} \nonumber \]
La molaridad se abrevia M (a menudo denominada “molar”), y las unidades a menudo se abrevian como mol/L Es importante recordar que “mol” en esta expresión se refiere a moles de soluto y que “L” se refiere a litros de solución. Por ejemplo, si tienes 1.5 mol de NaCl disueltos en 0.500 L de solución, su molaridad es por lo tanto
\[\mathrm{\dfrac{1.5\: mol\: NaCl}{0.500\: L\: solution}=3.0\: M\: NaCl} \nonumber \]
que se lee como “cloruro de sodio de tres puntos oh molar”. A veces se agrega (ac) cuando el solvente es agua, como en “NaCl 3.0 M (ac)”.
Antes de que se pueda calcular una concentración de molaridad, la cantidad del soluto debe expresarse en moles, y el volumen de la solución debe expresarse en litros.
Si la cantidad del soluto se da en unidades de masa, debe convertir unidades de masa en unidades molares antes de usar la definición de molaridad para calcular la concentración. Por ejemplo, ¿cuál es la concentración molar de una solución de 22.4 g de HCl disueltos en 1.56 L?
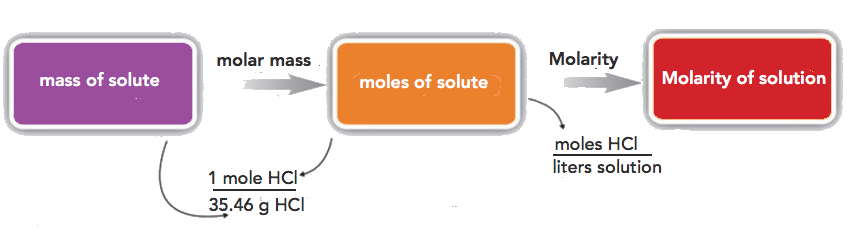
Paso 1: convertir la masa de soluto en moles usando la masa molar de HCl (36.46 g/mol):
\[22.4\cancel{gHCl}\times \dfrac{1\: mol\: HCl}{36.46\cancel{gHCl}}=0.614\, mol\; HCl \nonumber \]
Paso 2: usar la definición de molaridad para determinar la concentración:
\[M \: =\: \dfrac{0.614\: mol\: HCl}{1.56L\: solution}=0.394\, M HCl \nonumber \]
¿Cuál es la molaridad de una solución acuosa de 25.0 g de NaOH en 750 mL?
Solución
Antes de sustituir estas cantidades en la definición de molaridad, debemos convertirlas en las unidades adecuadas. La masa de NaOH debe convertirse en moles de NaOH. La masa molar de NaOH es de 40.00 g/mol:
\(\mathrm{25.0\: g\: NaOH\times\dfrac{1\: mol\: NaOH}{40.00\: g\: NaOH}=0.625\: mol\: NaOH}\)
A continuación, convertimos las unidades de volumen de mililitros a litros:
\(\mathrm{750\: mL\times\dfrac{1\: L}{1,000\: mL}=0.750\: L}\)
Ahora que las cantidades se expresan en las unidades propias, podemos sustituirlas en la definición de molaridad:
\(\mathrm{M=\dfrac{0.625\: mol\: NaOH}{0.750\: L}=0.833\: M\: NaOH}\)
Si una taza de café de 350 mL contiene 0.150 g de cafeína (C 8 H 10 N 4 O 2), ¿cuál es la molaridad de esta solución de cafeína?
- Contestar
-
0.00221 M
Uso de la molaridad en los cálculos
La definición de molaridad también puede utilizarse para calcular un volumen necesario de solución, dada su concentración y el número de moles deseados, o el número de moles de soluto (y posteriormente, la masa del soluto), dada su concentración y volumen. Al igual que en la concentración porcentual, la molaridad también se puede expresar como un factor de conversión.
La molaridad se define como moles de soluto por litro de solución. Hay un 1 entendido en el denominador del factor de conversión. Por ejemplo, una solución 3.0 M de sacarosa significa que hay tres moles de sacarosa disueltos en cada litro de solución. Matemáticamente, esto se establece de la siguiente manera:
3.0 moles de sacarosa = 1 L de solución
Dividiendo ambos lados de esta expresión por cada lado, generamos dos posibles factores de conversión:
\(\mathrm{\dfrac{3.0\: mol\: sucrose}{1\: L\: solution}}\)o \(\mathrm{\dfrac{1\: L\: solution}{3.0\: mol\: sucrose}}\)
El primer factor de conversión se puede utilizar para convertir de volumen (L) de solución a moles de soluto, y el segundo convierte de moles de soluto a volumen (L) de solución.

Por ejemplo, supongamos que se nos pregunta cuántos moles de sacarosa están presentes en 0.108 L de una solución de sacarosa 3.0 M. El volumen dado (0.108 L) se multiplica por el primer factor de conversión para cancelar las unidades L, y encontrar que están presentes 0.32 moles de sacarosa.
\[0.108\cancel{L\, solution}\times \dfrac{3.0\, mol\, sucrose}{\cancel{1L\, solution}}=0.32\, mol\, sucrose \nonumber \]
¿Cuántos litros de solución de sacarosa 3.0 M se necesitan para obtener 4.88 mol de sacarosa? En tal conversión, multiplicamos lo dado (4.88 moles de sacarosa) con el segundo factor de conversión. Esto cancela las unidades moles y las convierte en litros de solución.
\[4.88\cancel{mol\, sucrose}\times \dfrac{1\, L\, solution}{\cancel{3.0\, mol\, sucrose}}=1.63\, L\, solution \nonumber \]
- ¿Qué volumen de una solución 0.0753 M de dimetilamina [(CH 3) 2 NH] se necesita para obtener 0.450 mol del compuesto?
- Se mezcla etilenglicol (C 2 H 6 O 2) con agua para hacer refrigerantes de motor automático. ¿Cuántos gramos de C 2 H 6 O 2 hay en 5.00 L de una solución acuosa de 6.00 M?
Solución
1. Para resolver el volumen, multiplique el “dado” (0.450 mol de dimetilamina) con el factor de conversión de molaridad (0.0753 M). Utilice el factor de conversión adecuado para cancelar la unidad “mol” y obtener el volumen unitario (L) de solución:
\(\mathrm{0.450\: mol\: dimethylamine\times\dfrac{1\: L\: solution}{0.0753\: mol\: dimethylamine}=5.98\: L\: solution}\)
2. La estrategia para resolver este problema es convertir el volumen dado (5.00 L) utilizando los 6.00 M (factor de conversión) para resolver moles de etilenglicol, que luego se puede convertir en gramos.
Paso 1: Convertir el volumen dado (5.00 L) en moles de etilenglicol.
\(\mathrm{5.00\: L\: solution\times\dfrac{6.00\: mol\: C_2H_6O_2}{1\: L\: solution}=30.0\: mol\: C_2H_6O_2}\)
Paso 2: Convertir 30.0 moles C 2 H 6 O 2 a gramos C 2 H 6 O 2. Masa molar de C 2 H 6 O 2 = 62.08 g/mol
\(\mathrm{30.0\: mol\: C_2H_6O_2\times\dfrac{62.08\: g\: C_2H_6O_2}{1\: mol\: C_2H_6O_2}=1,860\: g\: C_2H_6O_2}\)
El mismo problema de dos pasos también se puede resolver en una sola línea, en lugar de como dos pasos separados, de la siguiente manera:
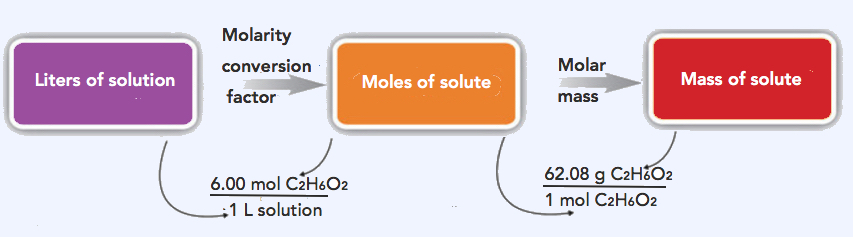
\(\mathrm{5.00\: L\: solution\times\dfrac{6.00\: mol\: C_2H_6O_2}{1\: L\: solution}\times\dfrac{62.08\: g\: C_2H_6O_2}{1\: mol\: C_2H_6O_2}=1,860\: g\: C_2H_6O_2}\)
La respuesta final se redondea a 3 cifras significativas. Así, hay 1,860 g de C 2 H 6 O 2 en la cantidad especificada de refrigerante del motor.
Nota: La dimetilamina tiene un olor “a pescado”. De hecho, los compuestos orgánicos llamados aminas causan el olor de los peces en descomposición.
- ¿Qué volumen de una solución 0.0753 M de dimetilamina [(CH 3) 2 NH] se necesita para obtener 0.450 mol del compuesto?
- Se mezcla etilenglicol (C 2 H 6 O 2) con agua para hacer refrigerantes de motor automático. ¿Cuántos gramos de C 2 H 6 O 2 hay en 5.00 L de una solución acuosa de 6.00 M?
Solución
Este es un método alternativo en caso de que no quieras usar el factor de conversión para molaridad. En ambas partes, utilizaremos la definición de molaridad para resolver por la cantidad deseada.
- \(\mathrm{0.0753\: M=\dfrac{0.450\: mol\: (CH_3)_2NH}{volume\: of\: solution}}\)
Para resolver el volumen de solución, multiplicamos ambos lados por volumen de solución y dividimos ambos lados por el valor de molaridad para aislar el volumen de solución en un lado de la ecuación:
\(\mathrm{volume\:of\:solution = \dfrac{0.450\:mol\:(CH_3)_2NH}{0.0753\:M}=5.98\:L}\)
Obsérvese que debido a que la definición de molaridad es mol/L, la división de mol por M produce L, una unidad de volumen.
- La masa molar de C 2 H 6 O 2 es de 62.08 g/mol., entonces
\(\mathrm{6.00\: M=\dfrac{moles\: of\: solute}{5.00\: L}}\)
Para resolver el número de moles de soluto, multiplicamos ambos lados por el volumen:
moles de soluto = (6.00 M) (5.00 L) = 30.0 mol
Tenga en cuenta que debido a que la definición de molaridad es mol/L, el producto M × L da mol, una unidad de cantidad. Ahora, usando la masa molar de C 3 H 8 O 3, convertimos mol a g:
\(\mathrm{30.0\: mol\times\dfrac{62.08\: g}{mol}=1,860\: g}\)
Así, hay 1,860 g de C 2 H 6 O 2 en la cantidad especificada de refrigerante del motor.
- ¿Qué volumen de una solución 0.0902 M de ácido fórmico (HCOOH) se necesita para obtener 0.888 mol de HCOOH?
- El ácido acético (HC 2 H 3 O 2) es el ácido en vinagre. ¿Cuántos gramos de HC 2 H 3 O 2 hay en 0.565 L de una solución 0.955 M?
- Contestar
-
a. 9.84 L
b. 32.4 g
Uso de la molaridad en problemas de estequiometría
De todas las formas de expresar la concentración, la molaridad es la más utilizada en problemas estequiométricos porque está directamente relacionada con la unidad molar. Considere la siguiente ecuación química:
HCl (ac) + NaOH (s) → H 2 O (l) + NaCl (ac)
Supongamos que queremos saber cuántos litros de solución acuosa de HCl reaccionarán con una masa dada de NaOH. Un enfoque típico para responder a esta pregunta es el siguiente:
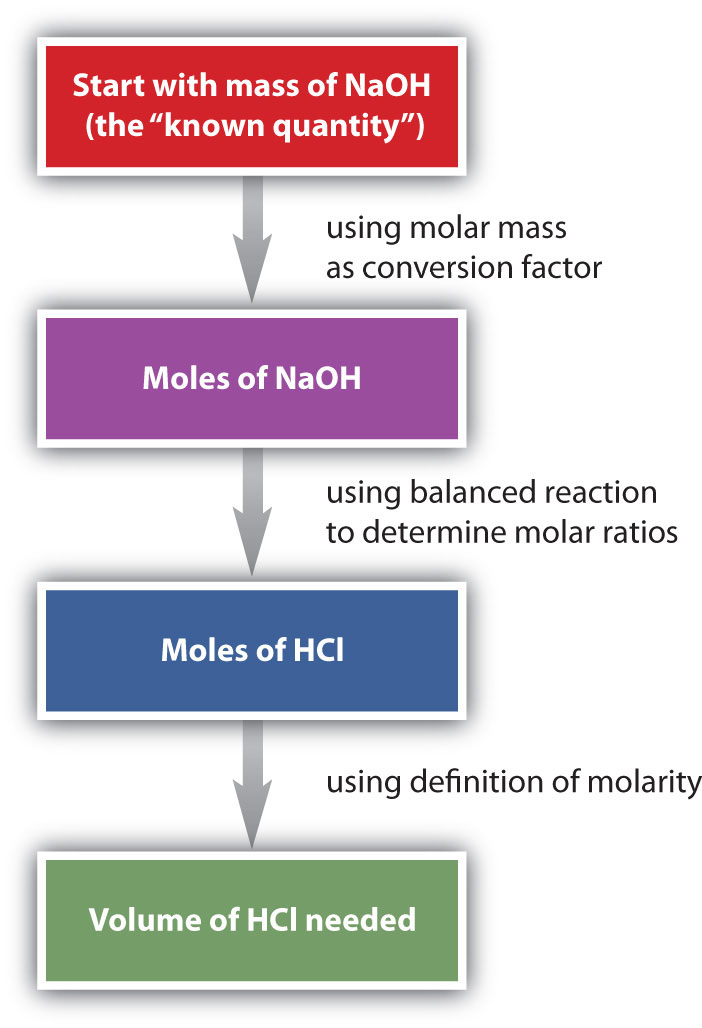
En sí mismo, cada paso es una conversión sencilla. Es la combinación de los pasos que es una poderosa herramienta cuantitativa para la resolución de problemas.
¿Cuántos mililitros de una solución de HCl 2.75 M se necesitan para reaccionar con 185 g de NaOH? La ecuación química equilibrada para esta reacción es la siguiente:
HCl (ac) + NaOH (s) → H 2 O (l) + NaCl (ac)
Solución
Seguiremos el diagrama de flujo para responder a esta pregunta. Primero, convertimos la masa de NaOH en moles de NaOH usando su masa molar, 40.00 g/mol:
\(\mathrm{185\: g\: NaOH\times\dfrac{1\: mol\: NaOH}{40.00\: g\: NaOH}=4.63\: mol\: NaOH}\)
Usando la ecuación química equilibrada, vemos que existe una relación uno a uno de moles de HCl a moles de NaOH. Utilizamos esto para determinar el número de moles de HCl necesarios para reaccionar con la cantidad dada de NaOH:
\(\mathrm{4.63\: mol\: NaOH\times\dfrac{1\: mol\: HCl}{1\: mol\: NaOH}=4.63\: mol\: HCl}\)
Finalmente, utilizamos la definición de molaridad para determinar el volumen de HCl 2.75 M necesario:
\(\mathrm{2.75\: M\: HCl=\dfrac{4.63\: mol\: HCl}{volume\: of\: HCl\: solution}}\)
\(\mathrm{volume\: of\: HCl=\dfrac{4.63\: mol\: HCl}{2.75\: M\: HCl}=1.68\: L\times\dfrac{1,000\: mL}{1\: L}=1,680\: mL}\)
Necesitamos 1,680 mL de HCl 2.75 M para reaccionar con el NaOH.
El mismo problema de varios pasos también se puede resolver en una sola línea, en lugar de como pasos separados, de la siguiente manera:
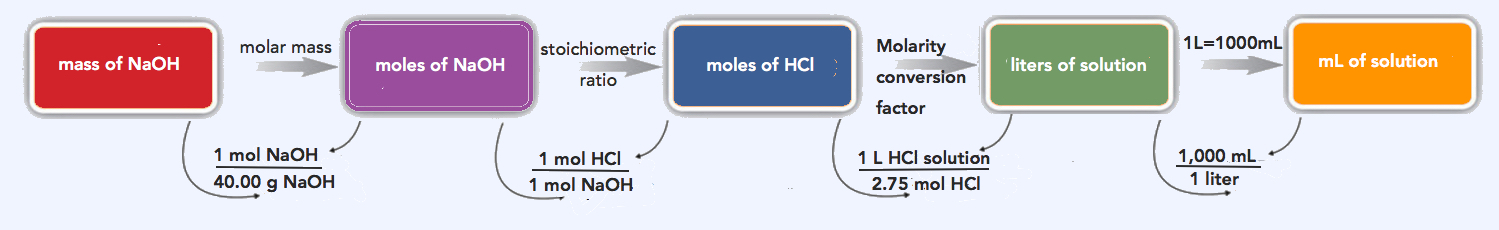
\(\mathrm{185\: g\: NaOH\times\dfrac{1\: mol\: NaOH}{40.00\: g\: NaOH}\times\dfrac{1\: mol\: HCl}{1\: mol\: NaOH}\times\dfrac{1\: L\: HCl\: solution}{2.75\: mol\: HCl}\times\dfrac{1000\: mL\: HCl\: solution}{1\: L\: HCl\: solution}=1,680\: mL\: HCl\: solution}\)
Nuestra respuesta final (redondeada a tres cifras significativas) es 1,680 mL de solución de HCl.
¿Cuántos mililitros de una solución 1.04 M H 2 SO 4 son necesarios para reaccionar con 98,5 g de Ca (OH) 2? La ecuación química equilibrada para la reacción es la siguiente:
\[H_2SO_{4(aq)} + Ca(OH)_{2(s)} \rightarrow 2H_2O_{(ℓ)} + CaSO_{4(aq)} \nonumber \]
- Contestar
-
1,280 mL
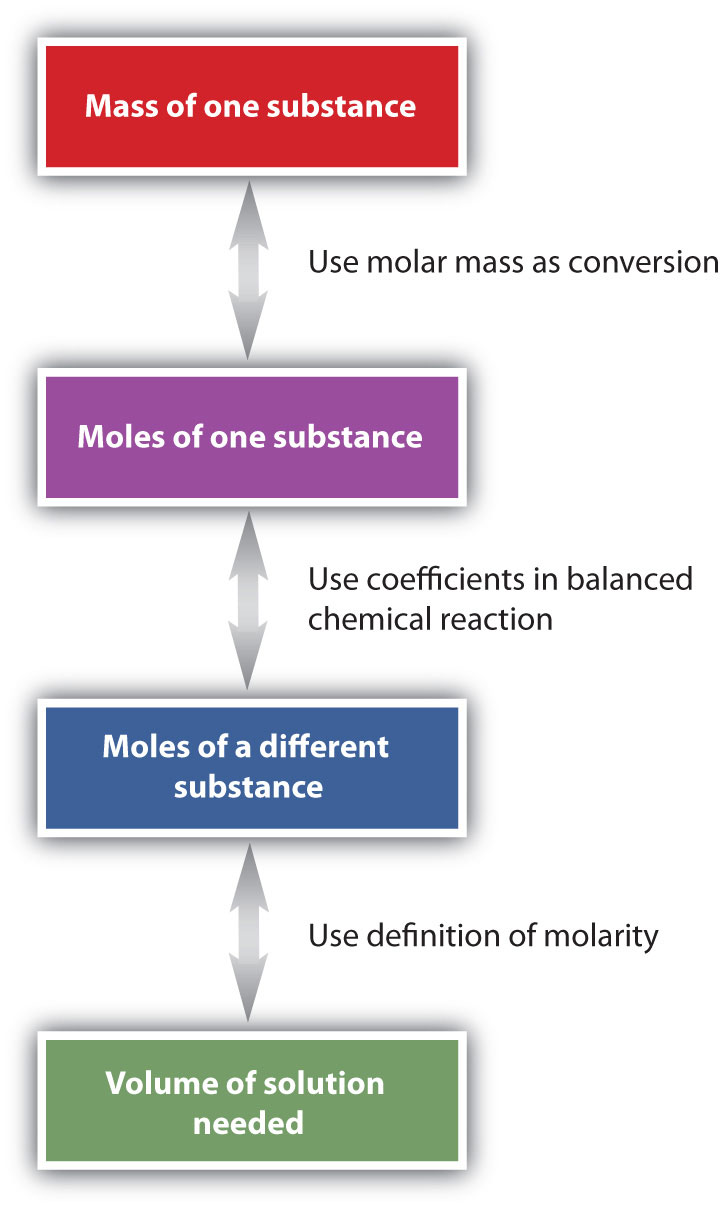
Los pasos generales para realizar problemas estequiométricos como este se muestran en la Figura\(\PageIndex{3}\). Es posible que desee consultar esta figura cuando se trabaja con soluciones en reacciones químicas. Las flechas dobles de la Figura\(\PageIndex{3}\) indican que se puede iniciar en cualquiera de los extremos del gráfico y, después de una serie de conversiones simples, determinar la cantidad en el otro extremo.
Muchos de los fluidos que se encuentran en nuestros cuerpos son soluciones. Los solutos van desde compuestos iónicos simples hasta proteínas complejas. En la\(\PageIndex{2}\) tabla se enumeran las concentraciones típicas de algunos de estos solutos.
| Solución | Soluto | Concentración (M) |
|---|---|---|
| plasma sanguíneo | Na + | 0.138 |
| K + | 0.005 | |
| Ca 2 + | 0.004 | |
| Mg 2 + | 0.003 | |
| Cl − | 0.110 | |
| HCO 3 − | 0.030 | |
| ácido estomacal | HCl | 0.10 |
| orina | NaCl | 0.15 |
| PO 4 3 − | 0.05 | |
| NH 2 CONH 2 (urea) | 0.30 | |
| *Nota: Las concentraciones son aproximadas y pueden variar ampliamente. | ||
¿Por qué es que podemos beber 1 cuarto de agua cuando tenemos sed y no ser perjudicados, pero si ingerimos 0.5 g de arsénico, podríamos morir? Hay un viejo dicho: la dosis hace que el veneno. Esto significa que lo que puede ser peligroso en algunas cantidades puede no ser peligroso en otras cantidades.
Tomemos el arsénico, por ejemplo. Algunos estudios muestran que la privación de arsénico limita el crecimiento de animales como pollos, cabras y cerdos, lo que sugiere que el arsénico es en realidad un oligoelemento esencial en la dieta. Los humanos están constantemente expuestos a pequeñas cantidades de arsénico del medio ambiente, por lo que no se dispone de estudios de humanos completamente libres de arsénico; si el arsénico es un oligoelemento esencial en las dietas humanas, probablemente se requiera del orden de 50 ppb o menos. Una dosis tóxica de arsénico corresponde a alrededor de 7,000 ppb y superior, que es más de 140 veces la cantidad traza que pueda requerir el organismo. Así, el arsénico no es venenoso en sí mismo. Más bien, es la cantidad la que es peligrosa: la dosis hace que el veneno.
De igual manera, tanto como se necesita agua para mantenernos vivos, demasiado de ella también es riesgosa para nuestra salud. Beber demasiada agua demasiado rápido puede llevar a una afección llamada intoxicación por agua, que puede ser fatal. El peligro en la intoxicación por agua no es que el agua misma se vuelva tóxica. Es que la ingestión de demasiada agua demasiado rápido diluye los iones de sodio, iones de potasio y otras sales en el torrente sanguíneo a concentraciones que no son lo suficientemente altas como para soportar las funciones cerebrales, musculares y cardíacas. El personal militar, los atletas de resistencia e incluso los excursionistas del desierto son susceptibles a la intoxicación por el agua si beben agua pero no reponen las sales perdidas en el sudor. Como muestra este ejemplo, ¡incluso las sustancias correctas en las cantidades incorrectas pueden ser peligrosas!

