10.4: El agua como ácido y como base
- Page ID
- 73062
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Escribir ecuaciones químicas para el agua que actúa como ácido y como base.
- Definir y usar la constante del producto iónico para el agua para calcular las concentraciones de\(\ce{H3O+}\) y\(\ce{OH-}\) en soluciones acuosas.
El agua (H 2 O) es un compuesto interesante en muchos aspectos. Aquí, consideraremos su capacidad para comportarse como un ácido o una base.
En algunas circunstancias, una molécula de agua aceptará un protón y así actuará como base de Brønsted-Lowry. Vimos un ejemplo en la disolución de HCl en H 2 O:
\[\rm{HCl + H_2O_{(ℓ)} \rightarrow H_3O^+_{(aq)} + Cl^−_{(aq)}} \label{Eq1} \]
En otras circunstancias, una molécula de agua puede donar un protón y así actuar como un ácido de Brønsted-Lowry. Por ejemplo, en presencia del ion amida, una molécula de agua dona un protón, haciendo amoníaco como producto:
\[H_2O_{(ℓ)} + NH^−_{2(aq)} \rightarrow OH^−_{(aq)} + NH_{3(aq)} \label{Eq2} \]
En este caso, NH 2 − es una base Brønsted-Lowry (el aceptor de protones).
Entonces, dependiendo de las circunstancias, H 2 O puede actuar como un ácido de Brønsted-Lowry o como una base de Brønsted-Lowry. El agua no es la única sustancia que puede reaccionar como ácido en algunos casos o como base en otros, sino que sin duda es el ejemplo más común y el más importante. Una sustancia que puede donar o aceptar un protón, dependiendo de las circunstancias, se denomina compuesto anfiprótico.
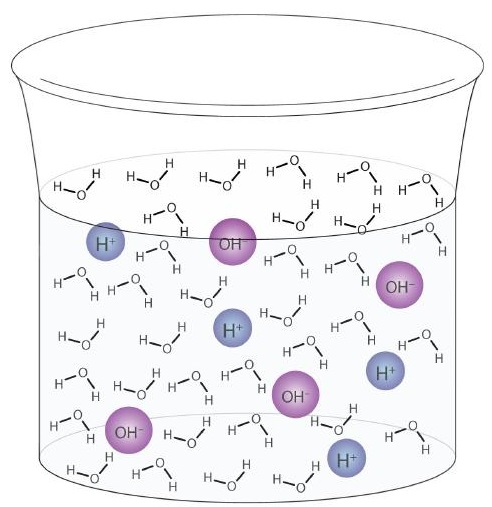
Una molécula de agua puede actuar como un ácido o una base incluso en una muestra de agua pura. Aproximadamente 6 de cada 100 millones (6 de cada 10 8) moléculas de agua experimentan la siguiente reacción:
\[H_2O_{(ℓ)} + H_2O_{(ℓ)} \rightarrow H_3O^+_{(aq)} + OH^−_{(aq)} \label{Eq3} \]
Este proceso se denomina autoionización del agua (Figura\(\PageIndex{1}\)) y ocurre en cada muestra de agua, ya sea pura o parte de una solución. La autoionización ocurre hasta cierto punto en cualquier líquido anfiprótico. (A modo de comparación, el amoníaco líquido también se somete a autoionización, pero solo aproximadamente 1 molécula de cada millón de millones (1 de cada 10 15) reacciona con otra molécula de amoníaco).
Identificar el agua como un ácido de Brønsted-Lowry o una base de Brønsted-Lowry.
- H 2 O (l) + NO 2 − (aq) → HNO 2 (aq) + OH − (aq)
- HC 2 H 3 O 2 (aq) + H 2 O (l) → H 3 O + (aq) + C 2 H 3 O 2 − (aq)
Solución
- En esta reacción, la molécula de agua dona un protón al ion NO 2 −, haciendo OH − (aq). Como donante de protones, H 2 O actúa como un ácido de Brønsted-Lowry.
- En esta reacción, la molécula de agua acepta un protón de HC 2 H 3 O 2, convirtiéndose en H 3 O + (aq). Como aceptor de protones, H 2 O es una base de Brønsted-Lowry.
Identificar el agua como un ácido de Brønsted-Lowry o una base de Brønsted-Lowry.
- HCOOH (aq) + H 2 O (l) → H 3 O + (aq) + HCOO − (aq)
- H 2 O (l) + PO 4 3 − (aq) → OH − (aq) + HPO 4 2 − (aq)
- Responder
-
1. H 2 O actúa como aceptor de protones (base Brønsted-Lowry)
2. H 2 O actúa como donante de protones (ácido de Brønsted-Lowry)
Disociación del agua
Como ya hemos visto, H 2 O puede actuar como un ácido o una base. Dentro de cualquier muestra dada de agua, algunas\(\ce{H2O}\) moléculas están actuando como ácidos, y otras\(\ce{H2O}\) moléculas actúan como bases. La ecuación química es la siguiente:
\[\color{red}{\underbrace{\ce{H2O}}_{\text{acid}}} + \color{blue}{\underbrace{\ce{H2O}}_{\text{base}}} \color{black} \ce{<=> H3O^{+} + OH^{−}} \label{Auto} \]
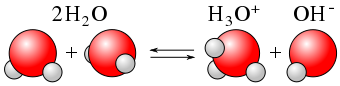
Similar a un ácido débil, la autoionización del agua es un proceso de equilibrio, y se escribe más adecuadamente de la siguiente manera:
\[\ce{H2O(ℓ) + H2O(ℓ) <=> H3O^{+}(aq) + OH^{-}(aq)} \label{Eq7} \]
A menudo usamos la forma simplificada de la reacción:
\[\ce{H2O(l) <=> H+(aq) + OH−(aq)} \nonumber \]
La constante de equilibrio para la autoionización del agua se conoce como el producto iónico para el agua y se le da el símbolo\(K_w\).
\[K_w = [\ce{H^{+}}][\ce{OH^{-}}] \nonumber \]
La constante ión-producto para el agua (\(K_w\)) es el producto matemático de la concentración de iones hidrógeno e iones hidróxido. Tenga en cuenta que H 2 O no está incluido en la expresión del producto iónico porque es un líquido puro. El valor de\(K_w\) es muy pequeño, de acuerdo con una reacción que favorece a los reactivos. A 25 o C, el valor determinado experimentalmente de\(K_w\) en agua pura es 1.0×10 −14.
\[K_w = [\ce{H^{+}}][\ce{OH^{−}}] = 1.0 \times 10^{−14} \nonumber \]
En una muestra de agua pura, las concentraciones de hidrógeno e iones hidróxido son iguales entre sí. Se dice que el agua pura o cualquier otra solución acuosa en la que se mantenga esta relación es neutra. Para encontrar la molaridad de cada ion,\(K_w\) se toma la raíz cuadrada de.
[H +] = [OH −] = 1,0×10 −7
El producto de estas dos concentraciones es 1.0×10 −14
\[\color{red}{\ce{[H^{+}]}} \color{black}{\times} \color{blue}{\ce{[OH^{-}]}} \color{black} = (1.0 \times 10^{-7})( 1.0 \times 10^{-7}) = 1.0 \times 10^{-14} \nonumber \]
- Para los ácidos, la concentración de H + o [H +] es mayor de 1.0×10 −7 M
- Para las bases, la concentración de OH − o [OH −] es mayor de 1.0×10 −7 M.
El HCl acuoso es un ejemplo de solución ácida. El cloruro de hidrógeno (HCl) se ioniza para producir iones H + y Cl − al disolverse en agua. Esto aumenta la concentración de iones H + en la solución. Según el principio de Le Chatelier, el equilibrio representado por
\[\ce{H2O(l) <=> H^{+}(aq) + OH^{−}(aq)} \nonumber \]
\[\ce{HCl(g) -> H^{+}(aq) + Cl^{−}(aq)} \nonumber \]
está f orced a la izquierda, hacia el reactivo. Como resultado, la concentración del ion hidróxido disminuye.
Ahora, considere KOH (aq), una solución básica. El hidróxido de potasio sólido (KOH) se disocia en agua para producir iones de potasio e iones de hidróxido.
KOH (s) → K + (aq) + OH − (aq)
El aumento en la concentración de los iones OH − provocará una disminución en la concentración de los iones H +.
No importa si la solución acuosa es un ácido, una base o neutro:y el producto iónico de [H +] [OH −] permanece constante.
- Para soluciones ácidas, [H +] es mayor que [OH −].
- Para soluciones básicas, [OH−] es mayor que [H +].
- Para soluciones neutras, [H 3 O +] = [OH−] = 1.0×10 −7 M
Esto significa que si sabes\(\ce{[H^{+}]}\) por una solución, puedes calcular qué\(\ce{[OH^{−}]}\)) tiene que ser para que el producto sea igual\(1.0 \times 10^{−14}\), o si sabes\(\ce{[OH^{−}]}\)), puedes calcular\(\ce{[H^{+}]}\). Esto también implica que a medida que una concentración sube, la otra debe bajar para compensar para que su producto siempre sea igual al valor de\(K_w\).
\[K_w = \color{red}{\ce{[H_3O^+]}} \color{blue}{\ce{[OH^{-}]}} \color{black} = 1.0 \times 10^{-14} \label{eq10} \]
El ácido clorhídrico (HCl) es un ácido fuerte, lo que significa que está 100% ionizado en solución. ¿Qué es el [H +] y el [OH −] en una solución de 2,0 × 10 −3 M HCl?
Solución
Paso 1: Enumere los valores conocidos y planifique el problema.
Conocido
- [HCl] = 2,0 × 10 −3 M
- Kw = 1.0×10 −14
Desconocido
- [H +] =? M
- [OH −] =? M
Debido a que el HCl está 100% ionizado, la concentración de iones H+ en solución será igual a la concentración original de HCl. Cada molécula de HCl que estaba originalmente presente ioniza en un ion H+ y un ion Cl-. La concentración de OH− puede entonces determinarse a partir del [H+] y el Kw.
Paso 2: Resolver.
[H +] =2.0×10 −3 M
Kw = [H +] [OH −] = 1.0×10 −14
[OH −] = Kw/ [H +] = 1.0×10 −14 /2.0 ×10 −3 = 5.0×10 −12 M
Paso 3: Piensa en tu resultado.
El [H +] es mucho mayor que el [OH −] porque la solución es ácida. Al igual que con otras constantes de equilibrio, la unidad para Kw se omite habitualmente.
Ejercicio\(\PageIndex{2}\)
El hidróxido de sodio (NaOH) es una base fuerte. ¿Qué es el [H +] y el [OH −] en una solución de NaOH 0.001 M a 25 °C?
- Responder
-
[OH −] = 0.001M o 1 x 10 -3 M; [H +] =1×10 − 11 M.
Ejercicios de revisión de conceptos
- Explique cómo el agua puede actuar como un ácido.
- Explique cómo el agua puede actuar como base.
RESPUESTAS
- En las condiciones adecuadas, H 2 O puede donar un protón, convirtiéndolo en un ácido Brønsted-Lowry.
- Bajo las condiciones adecuadas, H 2 O puede aceptar un protón, convirtiéndolo en una base Brønsted-Lowry.
Llave para llevar
- Las moléculas de agua pueden actuar tanto como ácido como base, dependiendo de las condiciones.
Ejercicios
- ¿El H 2 O (l) actúa como un ácido o una base?
H 2 O (l) + NH 4 + (aq) → H 3 O + (aq) + NH 3 (aq)
- ¿El H 2 O (l) actúa como un ácido o una base?
CH 3 − (aq) + H 2 O (l) → CH 4 (aq) + OH − (aq)
- En las soluciones acuosas de algunas sales, uno de los iones de la sal puede reaccionar con moléculas de agua. En algunas soluciones de C 2 H 3 O 2 −, puede ocurrir la siguiente reacción:
C 2 H 3 O 2 − (aq) + H 2 O (l) → HC 2 H 3 O 2 (aq) + OH − (aq)
¿El H 2 O actúa como un ácido o una base en esta reacción?
- En las soluciones acuosas de algunas sales, uno de los iones de la sal puede reaccionar con moléculas de agua. En algunas soluciones NH 4 +, puede ocurrir la siguiente reacción:
NH 4 + (aq) + H 2 O → NH 3 (aq) + H 3 O + (aq)
¿El H 2 O actúa como un ácido o una base en esta reacción?
- ¿Por qué el agua pura se considera neutra?
RESPUESTAS
- base
- ácido
- ácido
- base
5. Cuando el agua se ioniza, se forman cantidades iguales de H + (ácido) y OH − (base), por lo que la solución no es ni ácida ni básica: H 2 O (l) → H + (ac) + OH − (ac)
[NOTA LATERAL: Es raro tener realmente agua pura. El agua expuesta al aire generalmente será ligeramente ácida debido a que el gas dióxido de carbono disuelto, o ácido carbónico, disminuye el pH ligeramente por debajo de 7. Alternativamente, los minerales disueltos, como el carbonato cálcico (piedra caliza), pueden hacer que el agua sea ligeramente básica.]

