15.5: Oxidación de Aldehídos
- Page ID
- 73493
- Objetivo 1
- Objetivo 2
Los ldehídos y cetonas son muy parecidos en muchas de sus reacciones, debido a la presencia del grupo funcional carbonilo en ambas. Difieren mucho, sin embargo, en un tipo de reacción más importante: la oxidación. Los aldehídos se oxidan fácilmente a ácidos carboxílicos, mientras que las cetonas resisten la oxidación.

Los aldehídos se encuentran, de hecho, entre los compuestos orgánicos más fácilmente oxidados. Se oxidan por el oxígeno (O 2) en el aire a ácidos carboxílicos.
\[2RCHO + O_2 \rightarrow 2RCOOH \label{14.10.1} \]
La facilidad de oxidación ayuda a los químicos a identificar aldehídos. Un agente oxidante suficientemente suave puede distinguir los aldehídos no solo de las cetonas sino también de los alcoholes. El reactivo de Tollens, por ejemplo, es una solución alcalina de ion plata (Ag +) complejado con amoníaco (NH 3), que mantiene el ion Ag + en solución.
\[H_3N—Ag^+—NH_3 \label{14.10.2} \]
Cuando el reactivo Tollens oxida un aldehído, el ion Ag + se reduce a plata libre (Ag).
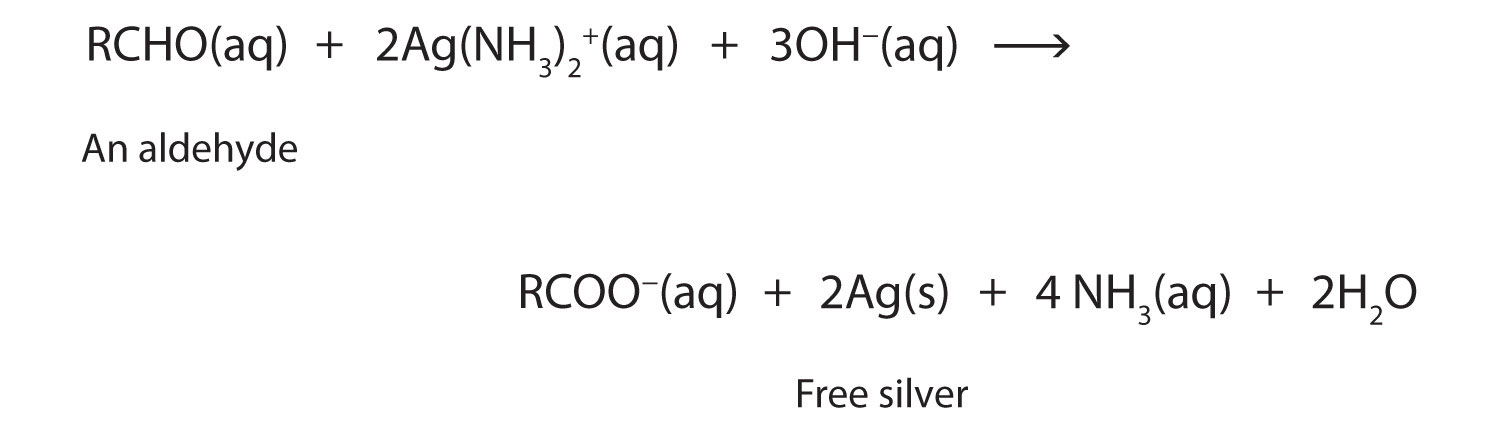
Depositada sobre una superficie de vidrio limpia, la plata produce un espejo (Figura\(\PageIndex{1}\)). Las cetonas ordinarias no reaccionan con el reactivo de Tollens.

Aunque las cetonas resisten la oxidación por agentes oxidantes ordinarios de laboratorio, se someten a combustión, al igual que los aldehídos.

