3.7: El concepto de densidad
- Page ID
- 76506
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Definir densidad.
- Utilizar la densidad como factor de conversión.
Densidad (\(\rho\)) es una propiedad física que se encuentra dividiendo la masa de un objeto por su volumen. Independientemente del tamaño de la muestra, la densidad es siempre constante. Por ejemplo, la densidad de una muestra pura de tungsteno es siempre de 19.25 gramos por centímetro cúbico. Esto significa que ya sea que tengas un gramo o un kilogramo de la muestra, la densidad nunca variará. La ecuación, como ya sabemos, es la siguiente:
\[\text{Density}=\dfrac{\text{Mass}}{\text{Volume}} \nonumber \]
o simplemente
\[\rho =\dfrac{m}{V} \label{eq2} \]
Con base en esta ecuación, es claro que la densidad puede, y lo hace, variar de elemento a elemento y de sustancia a sustancia debido a diferencias en la relación de masa y volumen. El agua pura, por ejemplo, tiene una densidad de 0.998 g/cm 3 a 25° C. Las densidades promedio de algunas sustancias comunes están en la Tabla\(\PageIndex{1}\). Aviso que el aceite de maíz tiene una relación masa/volumen menor que el agua. Esto significa que cuando se agrega al agua, el aceite de maíz “flotará”.
| Sustancia | Densidad a 25°C (g/cm3) |
|---|---|
| sangre | 1.035 |
| grasa corporal | 0.918 |
| leche entera | 1.030 |
| aceite de maíz | 0.922 |
| mayonesa | 0.910 |
| miel | 1.420 |
La densidad se puede medir para todas las sustancias: sólidos, líquidos y gases. Para sólidos y líquidos, la densidad a menudo se reporta usando las unidades de g/cm 3. Las densidades de los gases, que son significativamente menores que las densidades de sólidos y líquidos, a menudo se dan usando unidades de g/L.
Calcular la densidad de una muestra de 30.2 mL de alcohol etílico con una masa de 23.71002 g
Solución
Esta es una aplicación directa de la Ecuación\ ref {eq2}:
\[\rho = \dfrac{23.71002\,g}{30.2\,mL} = 0.785\, g/mL \nonumber \]
- Encuentre la densidad (en Kg/L) de una muestra que tenga un volumen de 36.5 L y una masa de 10.0 kg.
- Si se tiene una muestra de 2.130 mL de ácido acético con masa 0.002234 kg, ¿cuál es la densidad en Kg/L?
- Contestar a
- \(0.274 \,kg/L\)
- Respuesta b
- \(1.049 \,kg/L\)
Densidad como factor de conversión
Los factores de conversión también se pueden construir para convertir entre diferentes tipos de unidades. Por ejemplo, la densidad se puede utilizar para convertir entre la masa y el volumen de una sustancia. Considera el mercurio, que es un líquido a temperatura ambiente y tiene una densidad de 13.6 g/mL. La densidad nos dice que 13.6 g de mercurio tienen un volumen de 1 mL. Podemos escribir esa relación de la siguiente manera:
13.6 g de mercurio = 1 mL de mercurio
Esta relación se puede utilizar para construir dos factores de conversión:
\[\dfrac{13.6\:g}{1\:mL} = 1 \nonumber \]
y
\[\dfrac{1\:mL}{13.6\:g} = 1 \nonumber \]
¿Cuál usamos? Depende, como es habitual, de las unidades que necesitamos cancelar e introducir. Por ejemplo, supongamos que queremos conocer la masa de 2.0 mL de mercurio. Usaríamos el factor de conversión que tiene mililitros en la parte inferior (para que la unidad de mililitros cancele) y gramos en la parte superior, para que nuestra respuesta final tenga una unidad de masa:
\[\mathrm{2.0\:\cancel{mL}\times\dfrac{13.6\:g}{1\:\cancel{mL}}=27.2\:g=27\:g} \nonumber \]
En el último paso, limitamos nuestra respuesta final a dos cifras significativas porque la cantidad de volumen tiene sólo dos cifras significativas; el 1 en la unidad de volumen se considera un número exacto, por lo que no afecta el número de cifras significativas. El otro factor de conversión sería útil si se nos diera una masa y se nos pidiera encontrar volumen, como lo ilustra el siguiente ejemplo.
La densidad se puede utilizar como factor de conversión entre masa y volumen.
Un termómetro de mercurio para medir la temperatura de un paciente contiene 0.750 g de mercurio. ¿Cuál es el volumen de esta masa de mercurio?
Solución
| Pasos para la resolución de problemas | Conversión de unidades |
|---|---|
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. |
Dado: 0.750 g Buscar: mL |
| Enumere otras cantidades conocidas. | 13.6 g/mL (densidad de mercurio) |
| Preparar un mapa conceptual. | 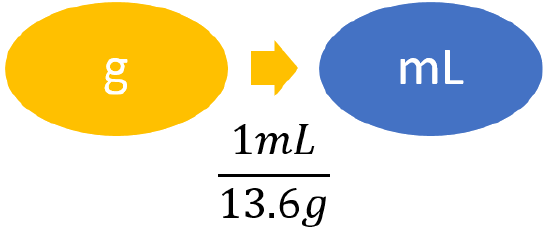 |
| Calcular. |
\[ 0.750 \; \cancel{\rm{g}} \times \dfrac{1\; \rm{mL}}{13.6 \; \cancel{\rm{g}}} = 0.055147 ... \; \rm{mL} \approx 0.0551\; \rm{mL} \nonumber \] Hemos limitado la respuesta final a tres cifras significativas. |
¿Cuál es el volumen de 100.0 g de aire si su densidad es 1.3 g/L?
- Responder
- \(77 \, L\)
Resumen
- La densidad se define como la masa de un objeto dividida por su volumen.
- La densidad se puede utilizar como factor de conversión entre masa y volumen.

