4.12: Experimento de Gota de Petróleo
- Page ID
- 70339
“¿Qué tan alto es usted? ¿Cuánto pesa?” Preguntas como estas son fáciles de responder porque tenemos herramientas para realizar las mediciones. Un palo de yarda o cinta métrica bastará para medir la altura. Puedes pararte en una báscula de baño y determinar tu peso.
Es un asunto muy diferente medir propiedades de objetos que no podemos ver a simple vista. Si queremos medir el tamaño de un germen, tenemos que usar un microscopio. Para aprender el tamaño de una sola molécula, tenemos que usar instrumentos aún más sofisticados. Entonces, ¿cómo mediríamos algo incluso más pequeño que una molécula, incluso más pequeño que un átomo?
Carga y masa del electrón
El hombre que midió las propiedades del electrón fue Robert Millikan (1868-1953). Se enseñó física mientras estudiaba en Oberlin College' ya que no había nadie en la facultad que le instruyera en este campo. Millikan completó una formación de posgrado en investigación en Estados Unidos y en Alemania. Sus estudios sobre las propiedades del electrón demostraron ser de gran valor en muchas áreas de la física y la química.

Experimento de gotas de petróleo
Millikan llevó a cabo una serie de experimentos entre 1908 y 1917 que le permitieron determinar la carga de un solo electrón, conocido como el experimento de gotas de petróleo.
Millikan roció diminutas gotas de aceite en una cámara. En su primer experimento, simplemente midió qué tan rápido cayeron las gotas bajo la fuerza de la gravedad. Entonces podría calcular la masa de las gotas individuales. Después, roció gotas de aceite y les aplicó una carga eléctrica mediante rayos X brillantes hacia arriba a través del fondo del aparato. Los rayos X ionizaron el aire, haciendo que los electrones se adhieran a las gotas de petróleo. Las gotas de aceite captaron carga estática y se suspendieron entre dos placas cargadas. Millikan pudo observar el movimiento de las gotas de aceite con un microscopio y encontró que las gotas se alinearon de manera específica entre las placas, con base en el número de cargas eléctricas que habían adquirido.
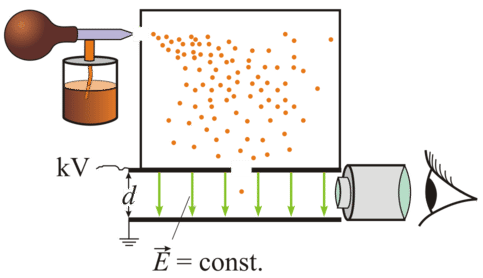
Millikan utilizó la información para calcular la carga de un electrón. Determinó que la carga era\(1.5924 \times 10^{-19} \: \text{C}\), donde\(\text{C}\) significa culombo, que es de un amperio*segundo. Hoy en día, el valor aceptado de la carga de un electrón es\(1.602176487 \times 10^{-19} \: \text{C}\). El valor experimental de Millikan demostró ser muy preciso; se encuentra dentro\(1\%\) del valor actualmente aceptado. Millikan posteriormente utilizó la información de su experimento de gotas de petróleo para calcular la masa de un electrón. El valor aceptado hoy en día es\(9.10938215 \times 10^{-31} \: \text{kg}\). Se encontró que la masa increíblemente pequeña del electrón era aproximadamente 1/1840 la masa de un átomo de hidrógeno. Por lo tanto, los Científicos se dieron cuenta de que los átomos deben contener otra partícula que lleve una carga positiva y sea mucho más masiva que el electrón.
Resumen
- El experimento de caída de aceite permitió a Millikan determinar la carga en el electrón.
- Posteriormente utilizó estos datos para determinar la masa del electrón.
Revisar
- ¿Cómo aprendió Millikan física en la universidad?
- ¿Qué usó Millikan para recoger la carga estática?
- ¿A dónde fueron las gotas de aceite para medirse?

