4.14: Experimento de lámina de oro
- Page ID
- 70322
¿Cuánto espacio ocupan los ladrillos?
Al mirar el mundo que nos rodea, se ve bastante sólido. Golpeamos con la mano contra una pared y la mano se detiene —no pasa (normalmente) por la pared. Pensamos en la materia como ocupando espacio. Pero hay mucho espacio vacío en la materia. De hecho, la mayor parte del asunto es el espacio vacío.
El experimento de lámina de oro
En 1911, Rutherford y sus compañeros de trabajo Hans Geiger y Ernest Marsden iniciaron una serie de experimentos pioneros que cambiarían por completo el modelo aceptado del átomo. Bombardearon láminas muy delgadas de lámina de oro con partículas alfa de rápido movimiento. Las partículas alfa, un tipo de partícula radiactiva natural, son partículas cargadas positivamente con una masa aproximadamente cuatro veces mayor que la de un átomo de hidrógeno.
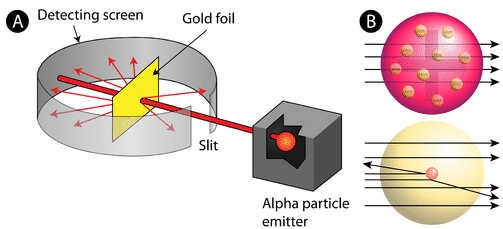
Según el modelo atómico aceptado —en el que la masa y la carga de un átomo se distribuyen uniformemente por todo el átomo—, los científicos plantearon la hipótesis de que todas las partículas alfa pasarían a través de la lámina de oro con solo una ligera desviación, o ninguna en absoluto. Sorprendentemente, si bien la mayoría de las partículas alfa de hecho no fueron desviadas, un porcentaje muy pequeño (aproximadamente 1 de cada 8000 partículas) rebotó en la lámina de oro en ángulos muy grandes. Algunos incluso fueron redirigidos de vuelta hacia la fuente. Ningún conocimiento previo los había preparado para este descubrimiento. En una famosa cita, Rutherford exclamó que era “como si hubieras disparado un proyectil [de artillería] de 15 pulgadas contra un trozo de tejido y volviera y te golpeara”.
Rutherford necesitaba idear un modelo completamente nuevo del átomo para poder explicar sus resultados. Debido a que la gran mayoría de las partículas alfa habían pasado por el oro, razonó que la mayor parte del átomo era espacio vacío. En contraste, las partículas que fueron altamente desviadas debieron haber experimentado una fuerza tremendamente poderosa dentro del átomo. Concluyó que toda la carga positiva y la mayor parte de la masa del átomo deben concentrarse en un espacio muy pequeño en el interior del átomo, al que llamó núcleo. El núcleo es el núcleo minúsculo, denso, central del átomo y está compuesto por protones y neutrones.
El modelo atómico de Rutherford se conoció como el modelo nuclear. En el átomo nuclear, los protones y neutrones, que comprenden casi toda la masa del átomo, se localizan en el núcleo en el centro del átomo. Los electrones se distribuyen alrededor del núcleo y ocupan la mayor parte del volumen del átomo. Vale la pena enfatizar lo pequeño que es el núcleo comparado con el resto del átomo. Si pudiéramos hacer estallar un átomo para ser del tamaño de un gran estadio de fútbol profesional, el núcleo sería aproximadamente del tamaño de una canica.
El modelo de Rutherford demostró ser un paso importante hacia una comprensión completa del átomo. Sin embargo, no abordó completamente la naturaleza de los electrones y la forma en que ocuparon el vasto espacio alrededor del núcleo. No fue hasta algunos años después que se logró una comprensión completa del electrón. Esto demostró ser la clave para comprender las propiedades químicas de los elementos.
Resumen
- El bombardeo de lámina de oro con partículas alfa mostró que un porcentaje muy pequeño de partículas alfa fueron desviadas.
- El modelo nuclear del átomo consiste en un interior pequeño y denso cargado positivamente rodeado por una nube de electrones.
Revisar
- ¿Qué es una partícula alfa?
- ¿Qué observó Rutherford al disparar miles y miles de partículas alfa a una delgada pieza de lámina de oro?
- ¿Cómo explicó Rutherford la observación de que la mayoría de las partículas alfa atravesaban directamente la lámina de oro?
- ¿Qué dijo sobre las partículas que fueron desviadas?
- Describir el modelo nuclear de Rutherford.

