5.5: Espectros de Emisión Atómica
- Page ID
- 70616
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Cuánta energía se necesita para disparar una flecha?
El tiro con arco como deporte o medio de defensa existe desde hace siglos. En reposo, no hay tensión en la cuerda del arco ni fuerza en la flecha. Cuando se tira de la cuerda y la flecha hacia atrás, ahora tenemos una situación en la que la energía cinética (tirar de la cuerda) se ha convertido en energía potencial (la tensión en la cuerda). El arquero libera la flecha y la energía potencial se traduce en energía cinética a medida que la flecha se mueve. Resulta que los electrones se comportan de la misma manera cuando la energía se pone en el sistema o se libera del sistema.
Espectros de emisión atómica
Los electrones en un átomo tienden a estar dispuestos de tal manera que la energía del átomo es lo más baja posible. El estado fundamental de un átomo es el estado energético más bajo del átomo. Cuando a esos átomos se les da energía, los electrones absorben la energía y se mueven a un nivel de energía superior. Estos niveles de energía de los electrones en los átomos se cuantifican, lo que significa nuevamente que el electrón debe moverse de un nivel de energía a otro en pasos discretos, en lugar de continuamente. Un estado excitado de un átomo es un estado donde su energía potencial es mayor que el estado fundamental. Un átomo en estado excitado no es estable. Cuando vuelve al estado fundamental, libera la energía que anteriormente había ganado en forma de radiación electromagnética.
Entonces, ¿cómo ganan energía los átomos en primer lugar? Una forma es pasar una corriente eléctrica a través de una muestra cerrada de un gas a baja presión. Dado que los niveles de energía electrónica son únicos para cada elemento, cada tubo de descarga de gas brillará con un color distintivo, dependiendo de la identidad del gas (ver abajo).

Los letreros de “neón” son ejemplos familiares de tubos de descarga de gas. No obstante, solo las señales que brillan con el color rojo-naranja que se ven en la figura en realidad están llenas de neón. Los signos de otros colores contienen diferentes gases o mezclas de gases.
Los científicos estudiaron el color rosado distintivo de la descarga de gas creada por el gas hidrógeno. Cuando un haz estrecho de esta luz fue visto a través de un prisma, la luz se separó en cuatro líneas de longitudes de onda muy específicas (y frecuencias desde entonces\(\lambda\) y\(\nu\) están inversamente relacionadas). Un espectro de emisión atómica es el patrón de líneas que se forman cuando la luz pasa a través de un prisma para separarlo en las diferentes frecuencias de luz que contiene. La siguiente figura muestra el espectro de emisión atómica del hidrógeno.
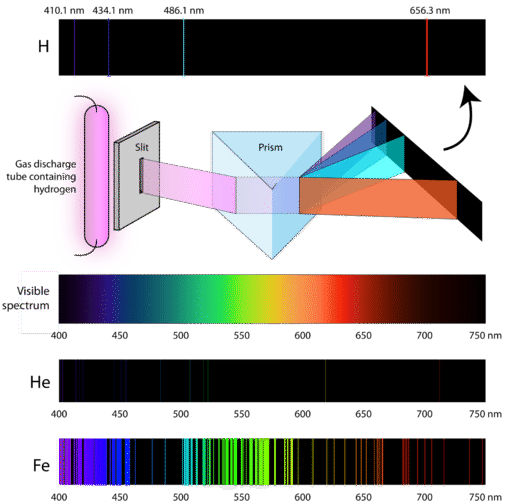
La teoría clásica no pudo explicar la existencia de espectros de emisión atómica, también conocidos como espectros de emisión lineal. Según la física clásica, un átomo de estado fundamental sería capaz de absorber cualquier cantidad de energía en lugar de solo cantidades discretas. De igual manera, cuando los átomos se relajaron de nuevo a un estado energético más bajo, se podría liberar cualquier cantidad de energía. Esto daría como resultado lo que se conoce como espectro continuo, donde se representan todas las longitudes de onda y frecuencias. La luz blanca vista a través de un prisma y un arco iris son ejemplos de espectros continuos. Los espectros de emisión atómica fueron una prueba más de la naturaleza cuantificada de la luz y condujeron a un nuevo modelo del átomo basado en la teoría cuántica.
Mira hacia el cielo por la noche y verás estrellas. ¿Cómo sabemos de qué están hechos? Echa un vistazo a esta simulación explora los colores atómicos y los ingredientes que conforman nuestro universo.
Resumen
- Los espectros de emisión atómica se producen cuando los electrones excitados regresan al estado fundamental.
- La luz emitida de los electrones corresponde a las energías de los electrones específicos.
Revisar
- ¿Cuál es el estado fundamental de un átomo?
- ¿Qué es un estado excitado?
- ¿Por qué vemos líneas de emisión cuando los electrones regresan al estado fundamental?

