5.13: Orbitales
- Page ID
- 70602
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Cómo es que tantos aviones son capaces de volar sin toparse entre sí?
La trayectoria de vuelo de un avión comercial está cuidadosamente regulada por la Administración Federal de Aviación. Cada avión debe mantener una distancia de cinco millas de otro avión volando a la misma altitud, y estar 2,000 pies por encima y por debajo de otra aeronave (1,000 pies si la altitud es inferior a 29,000 pies). Entonces, cada avión sólo tiene ciertas posiciones que se le permite mantener mientras vuela. La mecánica cuántica demuestra que los electrones tienen restricciones similares en sus ubicaciones.
Orbitales
Podemos aplicar nuestro conocimiento de los números cuánticos para describir la disposición de los electrones para un átomo dado. Esto lo hacemos con algo llamado configuraciones de electrones. Efectivamente son un mapa de los electrones para un átomo dado. Observamos los cuatro números cuánticos para un electrón dado y luego asignamos ese electrón a un orbital específico.
\(s\)Orbitales
Para cualquier valor de\(n\), un valor de\(l=0\) coloca ese electrón en un \(s\)orbital. Este orbital es de forma esférica:

\(p\)Orbitales
De la siguiente tabla, es evidente que existen tres orbitales posibles cuando\(l=1\). Estos son designados como \(p\)orbitales y tienen formas de mancuernas. Cada uno de los\(p\) orbitales tiene una orientación diferente en el espacio tridimensional.

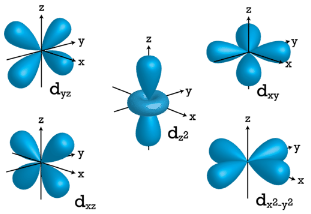
\(d\)Orbitales
Cuando\(l=2\),\(m_l\) los valores pueden ser\(-2, \: -1, \: 0, \: +1, \: +2\) para un total de cinco \(d\)orbitales. Tenga en cuenta que los cinco orbitales tienen orientaciones tridimensionales específicas.
\(f\)Orbitales
El conjunto más complejo de orbitales son los \(f\)orbitales. Cuando\(l=3\),\(m_l\) los valores pueden ser\(-3, \: -2, \: -1, \: 0, \: +1, \: +2, \: +3\) para un total de siete formas orbitales diferentes. Nuevamente, anotar las orientaciones específicas de los diferentes\(f\) orbitales.

| Número cuántico principal\(\left( n \right)\) | Subniveles Permitidos | Número de Orbitales por Subnivel | Número de Orbitales por Nivel de Energía Principal | Número de electrones por subnivel | Número de electrones por nivel de energía principal |
|---|---|---|---|---|---|
| \ (\ left (n\ right)\)” style="vertical-align:middle; "> 1 | \(s\) | 1 | 1 | 2 | 2 |
| \ (\ left (n\ right)\)” rowspan="2" style="vertical-align:middle; "> 2 | \(s\) | 1 | 4 | 2 | 8 |
| \(p\) | 3 | 6 | |||
| \ (\ left (n\ right)\)” rowspan="3" style="vertical-align:middle; "> 3 | \(s\) | 1 | 9 | 2 | 18 |
| \(p\) | 3 | 6 | |||
| \(d\) | 5 | 10 | |||
| \ (\ left (n\ right)\)” rowspan="4" style="vertical-align:middle; "> 4 | \(s\) | 1 | 16 | 2 | 32 |
| \(p\) | 3 | 6 | |||
| \(d\) | 5 | 10 | |||
| \(f\) | 7 | 14 |
Resumen
- Hay cuatro clases diferentes de orbitales de electrones.
- Los orbitales de electrones están determinados por el valor del número cuántico de momento angular\(l\).
Revisar
- ¿Qué es una configuración electrónica?
- ¿Cuántos electrones hay en el\(n=1\) orbital?
- ¿Cuál es el número total de electrones en un\(p\) orbital?
- ¿Cuántos electrones se necesita para llenar completamente un\(d\) orbital?

