5.18: Configuraciones de electrones
- Page ID
- 70603
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Qué tan grande es un archivo?
Si mantienes tus papeles en carpetas manila, puedes recoger una carpeta y ver cuánto pesa. Si quieres saber cuántos papeles diferentes (artículos, registros bancarios, o cualquier otra cosa que guardes en una carpeta), tienes que sacar todo y contar. Un directorio de computadoras, por otro lado, te dice exactamente cuánto tienes en cada archivo. Podemos obtener la misma información sobre los átomos. Si usamos un diagrama de llenado orbital, tenemos que contar las flechas. Cuando miramos los datos de configuración de electrones, simplemente sumamos los números.
Configuraciones de electrones
La notación de configuración electrónica elimina las cajas y flechas de los diagramas de llenado orbitales. Cada designación de subnivel ocupada se escribe seguida de un superíndice que es el número de electrones en ese subnivel. Por ejemplo, la configuración de hidrógeno es\(1s^1\), mientras que la configuración de helio es\(1s^2\). Múltiples subniveles ocupados se escriben uno tras otro. La configuración electrónica del litio es\(1s^2 2s^1\). La suma de los superíndices en una configuración electrónica es igual al número de electrones en ese átomo, que a su vez es igual a su número atómico.
Ejemplo\(\PageIndex{1}\)
Dibuja el diagrama de llenado orbital para carbono y escribe su configuración electrónica.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- número atómico de carbono, Z=6
Utilice el diagrama de orden de llenado para dibujar un diagrama de llenado orbital con un total de seis electrones. Sigue la regla de Hund. Escribe la configuración electrónica.
Paso 2: Construir diagrama.
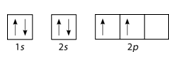
Configuración de electrones\(1s^2 2s^2 2p^2\)
Paso 3: Piensa en tu resultado.
Siguiendo el\(2s\) subnivel es el\(2p\), y\(p\) los subniveles constan siempre de tres orbitales. Los tres orbitales necesitan ser dibujados aunque uno o más estén desocupados. Según la regla de Hund, el sexto electrón entra en el segundo de esos\(p\) orbitales, con el mismo giro que el quinto electrón.
Elementos del Segundo Período
Los periodos se refieren a las filas horizontales de la tabla periódica. El primer periodo de la tabla periódica contiene únicamente los elementos hidrógeno y helio. Esto se debe a que el primer nivel de energía principal consiste únicamente en el\(s\) subnivel, por lo que solo se requieren dos electrones para llenar todo el nivel de energía principal. Cada vez que comienza un nuevo nivel de energía principal, como ocurre con el tercer elemento litio, se inicia un nuevo periodo en la tabla periódica. A medida que uno se mueve a través del segundo período, los electrones se agregan sucesivamente. Con berilio\(\left( Z=4 \right)\), el\(2s\) subnivel está completo y el\(2p\) subnivel comienza con boro\(\left( Z=5 \right)\). Dado que hay tres\(2p\) orbitales y cada orbital contiene dos electrones, el\(2p\) subnivel se llena después de seis elementos. El cuadro\(\PageIndex{1}\) muestra las configuraciones de electrones de los elementos en el segundo periodo.
| Nombre del elemento | Símbolo | Número atómico | Configuración de electrones |
|---|---|---|---|
| Litio | \(\ce{Li}\) | 3 | \(1s^2 2s^1\) |
| Berilio | \(\ce{Be}\) | 4 | \(1s^2 2s^2\) |
| Boro | \(\ce{B}\) | 5 | \(1s^2 2s^2 2p^1\) |
| Carbono | \(\ce{C}\) | 6 | \(1s^2 2s^2 2p^2\) |
| Nitrógeno | \(\ce{N}\) | 7 | \(1s^2 2s^2 2p^3\) |
| Oxígeno | \(\ce{O}\) | 8 | \(1s^2 2s^2 2p^4\) |
| Flúor | \(\ce{F}\) | 9 | \(1s^2 2s^2 2p^5\) |
| Neón | \(\ce{Ne}\) | 10 | \(1s^2 2s^2 2p^6\) |
Resumen
- La notación de configuración electrónica simplifica la indicación de dónde se encuentran los electrones en un átomo específico.
- Los superíndices se utilizan para indicar el número de electrones en un subnivel dado.
Revisar
- ¿Qué elimina la notación de configuración electrónica?
- ¿Cómo sabemos cuántos electrones hay en cada subnivel?
- Un átomo tiene la configuración electrónica de\(1s^2 2s^2 2p^5\). ¿Cuántos electrones hay en ese átomo?
- ¿De qué elemento tiene la configuración electrónica\(1s^2 2s^2 2p^6 3s^2\)?

