7.3: Cationes
- Page ID
- 70822
¿Alguna vez has ido a buscar oro?
Cuando los buscadores durante la Fiebre del Oro de California (1848-1855) buscaron pepitas de oro en la tierra, pudieron encontrar las pepitas porque el oro es un material no reactivo que existe en su estado elemental en muchos lugares. No todos tuvieron la suerte de encontrar pepitas de oro significativamente grandes, pero varios mineros sí se volvieron muy ricos (por supuesto, un gran número de otros regresaron a casa en quiebra).
Muchos de los elementos que conocemos no existen en su forma nativa. Son tan reactivos que solo se encuentran en compuestos. Estas formas no elementales se conocen como iones. Sus propiedades son muy distintas a las de los elementos de los que provienen. El término proviene de una palabra griega que significa “mover” y fue acuñado por primera vez por Michael Faraday, quien estudió el movimiento de materiales en un campo eléctrico.
Cationes
Algunos elementos pierden uno o más electrones en la formación de iones. Estos iones se conocen como "cationes" porque están cargados positivamente y migran hacia el electrodo negativo (cátodo) en un campo eléctrico. Al observar la tabla periódica a continuación, sabemos que los elementos del grupo 1 se caracterizan todos por tener un\(s\) electrón en la órbita exterior; los elementos del grupo 2 tienen dos\(s\) electrones en la órbita exterior. Estos electrones están unidos flojamente al átomo y pueden ser fácilmente removidos, dejando más protones en el átomo que hay electrones, de manera que el ion resultante tiene una carga positiva. Los cationes también se pueden formar a partir de la pérdida de electrones a muchos de los elementos de transición.
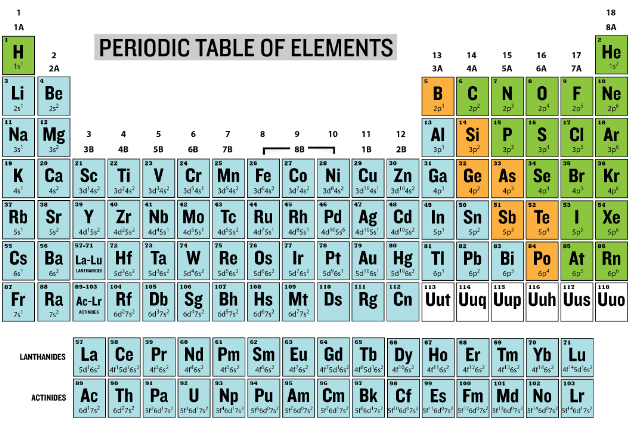
Los cationes son designados por el símbolo para el elemento padre y una carga más como superíndice después del símbolo del elemento, el catión potasio se indicaría como\(\ce{K^+}\). Tenga en cuenta que la carga se coloca después del símbolo y no antes de él. El ion potasio es monovalente, lo que significa que ha perdido un electrón y tiene una\(+1\) carga. El símbolo para el catión magnesio sería\(\ce{Mg^{2+}}\) o\(\ce{Mg^{++}}\) para indicar que ha perdido dos electrones y tiene una\(+2\) carga, por lo que el catión magnesio se denominaría catión divalente.
Los cationes se denominan simplemente como el elemento padre. El catión de sodio todavía se llama “sodio”. A menudo, la carga se adjuntaría para mayor claridad, por lo que el catión de sodio podría denominarse “sodio uno más”.
Aplicaciones de Cationes
Los cationes juegan un papel importante en nuestra vida diaria. Los iones de sodio, potasio y magnesio son esenciales para procesos como la regulación de la presión arterial y la contracción muscular. Los iones de calcio son una parte importante de la estructura ósea. Los iones de sodio se pueden utilizar en los ablandadores de agua para eliminar otros elementos dañinos. Ponemos cloruro de sodio (sal de mesa) en nuestros alimentos y lo usamos como conservante.
Resumen
- Los cationes se forman por la pérdida de uno o dos electrones de un elemento.
- Los grupos 1 y 2 elementos forman cationes.
- Los cationes se nombran de acuerdo con el elemento padre.
- Las cargas catiónicas se indican con un superíndice siguiendo el símbolo químico.
Revisar
- ¿Qué es un catión?
- Escribe el símbolo para el catión de bario.
- Escribe el símbolo para el catión de cesio.
- Enumere tres formas en que los cationes son útiles.

