7.9: Iones poliatómicos
- Page ID
- 70862
¿Alguna vez has leído la historia de Romeo y Julieta?
Shakespeare escribió: “Una rosa con cualquier otro nombre olería tan dulce” como parte de la romántica escena del balcón entre Romeo y Julieta en la famosa obra. Las dos familias eran rivales amargos, pero Julieta quiso decir que esta declaración significaba que amaba a Romeo sin importar cómo se llamara. Algunos nombres son simples —conocemos a Romeo principalmente como Romeo. La mayoría de nosotros tenemos nombre, segundo nombre (a menudo no se usa) y apellido. En algunas culturas, los nombres serán mucho más complejos. El nombre completo del famoso artista\(^\text{th}\) del siglo 20 Pablo Picasso es Pablo Diego José Francisco de Paula Juan Neponuceno María de los Remedios Cipriano de la Santísima Trinidad Mártir Patricio Clito Ruíz y Picasso.
Muchos materiales existen como compuestos simplemente binarios compuestos por un catión metálico y un anión no metálico, consistiendo cada ion en un solo tipo de átomo. También existen otras combinaciones de átomos, ya sea como complejos iónicos más grandes o moléculas completas. Algunos de los materiales más útiles con los que trabajamos contienen iones poliatómicos.
Iones Poliatómicos
Un ion poliatómico es un ion compuesto por más de un átomo. El ion amonio consiste en un átomo de nitrógeno y cuatro átomos de hidrógeno. Juntos, comprenden un solo ion con una\(1+\) carga y una fórmula de\(\ce{NH_4^+}\). El ion carbonato consiste en un átomo de carbono y tres átomos de oxígeno, y lleva una carga total de\(2-\). La fórmula del ion carbonato es\(\ce{CO_3^{2-}}\). Los átomos de un ion poliatómico están fuertemente unidos entre sí, y así todo el ion se comporta como una sola unidad. Las figuras a continuación muestran varios modelos.
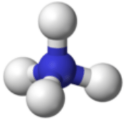

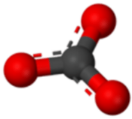
La siguiente tabla enumera una serie de iones poliatómicos por nombre y por fórmula. El encabezamiento de cada columna indica la carga sobre los iones poliatómicos de ese grupo. Tenga en cuenta que la gran mayoría de los iones enumerados son aniones, hay muy pocos cationes poliatómicos.
| \(1-\) | \(2-\) | \(3-\) | \(1+\) | \(2+\) |
|---|---|---|---|---|
| \ (1-\)” style="vertical-align:middle; ">acetato,\(\ce{CH_3COO^-}\) | \ (2-\)” style="vertical-align:middle; ">carbonato,\(\ce{CO_3^{2-}}\) | \ (3-\)” style="vertical-align:middle; ">arseniato,\(\ce{AsO_3^{3-}}\) | \ (1+\)” style="vertical-align:middle; ">amonio,\(\ce{NH_4^+}\) | \ (2+\)” style="vertical-align:middle; ">dimercurio,\(\ce{Hg_2^{2+}}\) |
| \ (1-\)” style="vertical-align:middle; ">bromato,\(\ce{BrO_3^-}\) | \ (2-\)” style="vertical-align:middle; ">cromato,\(\ce{CrO_4^{2-}}\) | \ (3-\)” style="vertical-align:middle; ">fosfito,\(\ce{PO_3^{3-}}\) | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">clorato,\(\ce{ClO_3^-}\) | \ (2-\)” style="vertical-align:middle; ">dicromato,\(\ce{Cr_2O_7^{2-}}\) | \ (3-\)” style="vertical-align:middle; ">fosfato,\(\ce{PO_4^{3-}}\) | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">clorito,\(\ce{ClO_2^-}\) | \ (2-\)” style="vertical-align:middle; ">fosfato de hidrógeno,\(\ce{HPO_4^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">cianuro,\(\ce{CN^-}\) | \ (2-\)” style="vertical-align:middle; ">oxalato,\(\ce{C_2O_4^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">fosfato de dihidrógeno,\(\ce{H_2PO_4^-}\) | \ (2-\)” style="vertical-align:middle; ">peróxido,\(\ce{O_2^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">carbonato de hidrógeno,\(\ce{HCO_3^-}\) | \ (2-\)” style="vertical-align:middle; ">silicato,\(\ce{SiO_3^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">sulfato de hidrógeno,\(\ce{HSO_4^-}\) | \ (2-\)” style="vertical-align:middle; ">sulfato,\(\ce{SO_4^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">sulfuro de hidrógeno,\(\ce{HS^-}\) | \ (2-\)” style="vertical-align:middle; ">sulfito,\(\ce{SO_3^{2-}}\) | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">hidróxido,\(\ce{OH^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">hipoclorito,\(\ce{ClO^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">nitrato,\(\ce{NO_3^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">nitrito,\(\ce{NO_2^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">perclorato,\(\ce{ClO_4^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
| \ (1-\)” style="vertical-align:middle; ">permanganato,\(\ce{MnO_4^-}\) | \ (2-\)” style="vertical-align:middle; "> | \ (3-\)” style="vertical-align:middle; "> | \ (1+\)” style="vertical-align:middle; "> | \ (2+\)” style="vertical-align:middle; "> |
La gran mayoría de los iones poliatómicos son aniones, muchos de los cuales terminan en -ato o -ite. Observe que en algunos casos, como el nitrato\(\left( \ce{NO_3^-} \right)\) y el nitrito\(\left( \ce{NO_2^-} \right)\), existen múltiples aniones que constan de los mismos dos elementos. En estos casos, la diferencia entre los iones está en el número de átomos de oxígeno presentes, mientras que la carga general es la misma. Como clase, estos se llaman oxoaniones. Cuando hay dos oxoaniones para un elemento en particular, el que tiene el mayor número de átomos de oxígeno obtiene el sufijo -ato, mientras que el que tiene el menor número de átomos de oxígeno obtiene el sufijo -ite. Los cuatro oxoaniones de cloro son los siguientes:
- \(\ce{ClO^-}\), hipoclorito
- \(\ce{ClO_2^-}\), clorito
- \(\ce{ClO_3^-}\), clorato
- \(\ce{ClO_4^-}\), perclorato
En casos como este, al ion con un átomo de oxígeno más que el anión -ato se le da un prefijo per-. Al ion con un átomo de oxígeno menos que el anión -ite se le da un prefijo hipo-.
Resumen
- Los iones poliatómicos contienen más de un tipo de átomo en el ion.
- La mayoría de los iones poliatómicos son aniones que se nombran terminando en -ate o -ite.
- Algunos aniones tienen múltiples formas y se nombran en consecuencia.
Revisar
- Escribe las fórmulas para los siguientes iones:
- amonio
- carbonato
- sulfato
- fosfato
- Nombra los siguientes iones:
- \(\ce{PO_3^{3-}}\)
- \(\ce{SiO_3^{2-}}\)
- \(\ce{OH^-}\)
- \(\ce{MnO_4^-}\)

