10.6: Hipótesis y volumen molar de Avogadro
- Page ID
- 71148
¿Cómo saben los buceadores si se quedarán sin gasolina?
Saber cuánto gas hay disponible para una inmersión es crucial para la supervivencia de un buceador. El tanque en la espalda del buceador está equipado con medidores para indicar cuánto gas está presente y cuál es la presión. Un conocimiento básico del comportamiento del gas permite al buceador evaluar cuánto tiempo puede permanecer bajo el agua sin desarrollar problemas.
Hipótesis y volumen molar de Avogadro
El volumen es una tercera forma de medir la cantidad de materia, después del recuento de artículos y la masa. Con líquidos y sólidos, el volumen varía mucho dependiendo de la densidad de la sustancia. Esto se debe a que las partículas sólidas y líquidas se empaquetan muy juntas con muy poco espacio entre las partículas. Sin embargo, los gases están compuestos en gran medida por espacios vacíos entre las partículas de gas reales (véase la figura a continuación).

En 1811, Amadeo Avogadro explicó que los volúmenes de todos los gases se pueden determinar fácilmente. La hipótesis de Avogadro establece que volúmenes iguales de todos los gases a la misma temperatura y presión contienen el mismo número de partículas. Dado que el volumen total que ocupa un gas se compone principalmente del espacio vacío entre las partículas, el tamaño real de las partículas en sí es casi insignificante. Un volumen dado de un gas con pequeñas partículas ligeras, como el hidrógeno\(\left( \ce{H_2} \right)\), contiene el mismo número de partículas que el mismo volumen de un gas pesado con partículas grandes, como el hexafluoruro de azufre,\(\ce{SF_6}\).
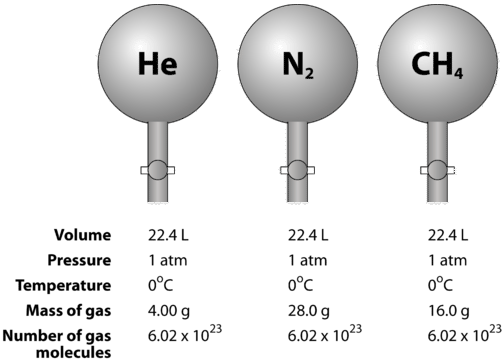
Los gases son compresibles, lo que significa que cuando se ponen a alta presión, las partículas son forzadas a acercarse entre sí. Esto disminuye la cantidad de espacio vacío y reduce el volumen del gas. El volumen de gas también se ve afectado por la temperatura. Cuando se calienta un gas, sus moléculas se mueven más rápido y el gas se expande. Debido a la variación en el volumen de gas debido a los cambios de presión y temperatura, la comparación de los volúmenes de gas debe hacerse a temperatura y presión estándar. La temperatura y presión estándar (STP) se define como\(0^\text{o} \text{C}\)\(\left( 273.15 \: \text{K} \right)\) y\(1 \: \text{atm}\) presión. El volumen molar de un gas es el volumen de un mol de un gas en STP. En STP, un mol (partículas\( 6.02 \times 10^{23}\) representativas) de cualquier gas ocupa un volumen de\(22.4 \: \text{L}\) (figura a continuación).

La siguiente figura ilustra cómo se puede ver el volumen molar al comparar diferentes gases. Muestras de helio\(\left( \ce{He} \right)\)\(\left( \ce{N_2} \right)\), nitrógeno y metano\(\left( \ce{CH_4} \right)\) están en STP. Cada uno contiene 1 mol o\(6.02 \times 10^{23}\) partículas. Sin embargo, la masa de cada gas es diferente y corresponde a la masa molar de ese gas:\(4.00 \: \text{g/mol}\)\(28.0 \: \text{g/mol}\) para\(\ce{He}\)\(\ce{N_2}\), para y\(16.0 \: \text{g/mol}\) para\(\ce{CH_4}\).
Resumen
- Los volúmenes iguales de gases en las mismas condiciones contienen el mismo número de partículas.
- La temperatura y presión estándar se abrevia (STP).
- La temperatura estándar es de 0°C (273.15 K) y la presión estándar es de 1 atm.
- En STP, un mol de cualquier gas ocupa un volumen de 22.4 L
Revisar
- Un contenedor está lleno de gas, ¿qué sabemos del espacio que realmente ocupa un gas?
- ¿Por qué necesitamos hacer todas nuestras comparaciones a la misma temperatura y presión?
- A temperatura y presión estándar, ¿1 mol de gas siempre es igual a cuántos litros?


