11.3: Ecuaciones de equilibrio
- Page ID
- 70363
¿Alguna sobras?
Cuando cocinas una comida, muy a menudo hay sobras porque preparaste más de lo que la gente comería de una sola vez. A veces cuando reparas un equipo, terminas con lo que se llaman “piezas de bolsillo”, piezas pequeñas que te metes en el bolsillo porque no estás seguro de a dónde pertenecen. La química trata de evitar las sobras y las piezas de bolsillo. En los procesos químicos normales, no podemos crear ni destruir la materia (ley de conservación de la masa). Si empezamos con diez átomos de carbono, necesitamos terminar con diez átomos de carbono. La teoría atómica de John Dalton decía que las reacciones químicas básicamente implican el reordenamiento de los átomos. Las ecuaciones químicas necesitan seguir estos principios para ser correctas.
Equilibrio de ecuaciones químicas
Una ecuación equilibrada es una ecuación química en la que se conserva la masa y hay números iguales de átomos de cada elemento en ambos lados de la ecuación. Podemos escribir una ecuación química para la reacción del carbono con gas hidrógeno para formar metano\(\left( \ce{CH_4} \right)\):
\[\begin{array}{ccccc} \ce{C} \left( s \right) & + & \ce{H_2} \left( g \right) & \rightarrow & \ce{CH_4} \left( g \right) \\ 2 \: \ce{C} \: \text{atoms} & & 2 \: \ce{H} \: \text{atoms} & & 1 \: \ce{C} \: \text{atom,} \: 4 \: \ce{H} \: \text{atoms} \end{array}\nonumber \]
Para escribir una ecuación correcta, primero se debe escribir la ecuación del esqueleto correcta con las fórmulas químicas correctas. Recordemos que el hidrógeno es una molécula diatómica y así se escribe como\(\ce{H_2}\).
Cuando contamos el número de átomos de ambos elementos, mostrados bajo la ecuación, vemos que la ecuación no está equilibrada. Solo hay 2 átomos de hidrógeno en el lado reactivo de la ecuación, mientras que hay 4 átomos de hidrógeno en el lado del producto. Podemos equilibrar la ecuación anterior sumando un coeficiente de 2 frente a la fórmula para hidrógeno.
\[\ce{C} \left( s \right) + 2 \ce{H_2} \left( g \right) \rightarrow \ce{CH_4} \left( g \right)\nonumber \]
Un coeficiente es un pequeño número entero colocado delante de una fórmula en una ecuación para equilibrarlo. El 2 frente a los\(\ce{H_2}\) medios que hay un total de\(2 \times 2 = 4\) átomos de hidrógeno como reactivos. Visualmente, la reacción se parece a la figura de abajo.
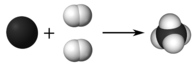
En la ecuación equilibrada, hay un átomo de carbono y cuatro átomos de hidrógeno a ambos lados de la flecha. A continuación se presentan pautas para escribir y equilibrar ecuaciones químicas.
- Determinar las fórmulas químicas correctas para cada reactivo y producto.
- Escribe la ecuación del esqueleto.
- Contar el número de átomos de cada elemento que aparece como reactivo y como producto. Si un ion poliatómico no cambia en ambos lados de la ecuación, cuéntelo como una unidad.
- Equilibrar cada elemento uno a la vez colocando coeficientes delante de las fórmulas.
- Lo mejor es comenzar equilibrando elementos que solo aparecen en una fórmula química a cada lado de la ecuación.
- No se escribe ningún coeficiente para un 1.
- NUNCA cambie los subíndices en una fórmula química; solo puede equilibrar ecuaciones usando coeficientes.
- Verifique cada átomo o ion poliatómico para asegurarse de que sean iguales en ambos lados de la ecuación.
- Asegúrese de que todos los coeficientes estén en la relación más baja posible. Si es necesario, reducir a la relación más baja.
Ejemplo\(\PageIndex{1}\): Balancing Chemical Equations
Se mezclan soluciones acuosas de nitrato de plomo (II) y cloruro de sodio. Los productos de la reacción son una solución acuosa de nitrato de sodio y un precipitado sólido de cloruro de plomo (II). Escribe la ecuación química balanceada para esta reacción.
Solución
Paso 1: Planear el problema.
Siga los pasos para escribir y equilibrar una ecuación química listada en el texto.
Paso 2: Resolver.
Escribe la ecuación del esqueleto con las fórmulas correctas.
\[\ce{Pb(NO_3)_2} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{PbCl_2} \left( s \right)\nonumber \]
Contar el número de cada átomo o ion poliatómico en ambos lados de la ecuación.
\[\begin{array}{ll} \textbf{Reactants} & \textbf{Products} \\ 1 \: \ce{Pb} \: \text{atom} & 1 \: \ce{Pb} \: \text{atom} \\ 2 \: \ce{NO_3^-} \: \text{ions} & 1 \: \ce{NO_3^-} \: \text{ions} \\ 1 \: \ce{Na} \: \text{atom} & 1 \: \ce{Na} \: \text{atom} \\ 1 \: \ce{Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atoms} \end{array}\nonumber \]
Los iones nitrato y los átomos de cloro están desequilibrados. Comience colocando un 2 delante de la\(\ce{NaCl}\). Esto aumenta los recuentos de reactivos a 2\(\ce{Na}\) átomos y 2\(\ce{Cl}\) átomos. Después coloca un 2 frente a la\(\ce{NaNO_3}\). El resultado es:
\[\ce{Pb(NO_3)_2} \left( aq \right) + 2 \ce{NaCl} \left( aq \right) \rightarrow 2 \ce{NaNO_3} \left( aq \right) + \ce{PbCl_2} \left( s \right)\nonumber \]
El nuevo conteo para cada átomo e ion poliatómico se convierte en:
\[\begin{array}{ll} \textbf{Reactants} & \textbf{Products} \\ 1 \: \ce{Pb} \: \text{atom} & 1 \: \ce{Pb} \: \text{atom} \\ 2 \: \ce{NO_3^-} \: \text{ions} & 2 \: \ce{NO_3^-} \: \text{ions} \\ 2 \: \ce{Na} \: \text{atom} & 2 \: \ce{Na} \: \text{atom} \\ 2 \: \ce{Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atoms} \end{array}\nonumber \]
Paso 3: Piensa en tu resultado.
La ecuación ahora está equilibrada ya que hay números iguales de átomos de cada elemento en ambos lados de la ecuación.
Practica el equilibrio de ecuaciones químicas con esta simulación:
Resumen
- Se describe el proceso de equilibrio de ecuaciones químicas.
Revisar
- ¿Cuál es la ley de conservación de la masa?
- ¿Cómo describió Dalton el proceso de una reacción química?
- ¿Por qué no cambiamos los subíndices para equilibrar una ecuación?


