12.7: Reactivo limitante
- Page ID
- 70317
¿No odias quedarte sin ingredientes para cocinar?
Cocinar es un gran ejemplo de la química cotidiana. Para poder seguir correctamente una receta, un cocinero necesita asegurarse de que tiene suficientes todos los ingredientes necesarios para poder elaborar su plato. Supongamos que estás decidiendo hacer unos panqueques para un grupo numeroso de personas. La receta en la caja indica que se necesitan los siguientes ingredientes para cada lote de panqueques:
\(1\)taza de mezcla para panqueques
\(\frac{3}{4}\)taza de leche
\(1\)huevo
\(1\)cucharada de aceite vegetal
Ahora revisas la despensa y el refrigerador y ves que tienes disponibles los siguientes ingredientes:
2 cajas de mezcla para panqueques (8 tazas)
Medio galón de leche (4 tazas)
2 huevos
Botella llena de aceite vegetal (aproximadamente 3 tazas)
La pregunta que debes hacer es: ¿cuántos lotes de panqueques puedo hacer? La respuesta es dos. A pesar de que tienes suficiente mezcla para panqueques, leche y aceite para hacer muchos más lotes de panqueques, estás limitado por el hecho de que solo tienes dos huevos. Tan pronto como hayas hecho dos lotes de panqueques, te quedarás sin huevos y tu “reacción” estará completa.
Reactivo limitante
Para un químico, la ecuación química equilibrada es la receta que se debe seguir. Como ya has visto antes, el proceso Haber es una reacción en la que se combina gas nitrógeno con gas hidrógeno para formar amoníaco. La ecuación equilibrada se muestra a continuación.
\[\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\nonumber \]
Sabemos que los coeficientes de la ecuación equilibrada indican la relación molar que se requiere para que ocurra esta reacción. Un mol de\(\ce{N_2}\) reaccionará con tres moles de\(\ce{H_2}\) para formar dos moles de\(\ce{NH_3}\).
Ahora supongamos que un químico iba a reaccionar tres moles de\(\ce{N_2}\) con seis moles de\(\ce{H_2}\) (ver figura abajo).
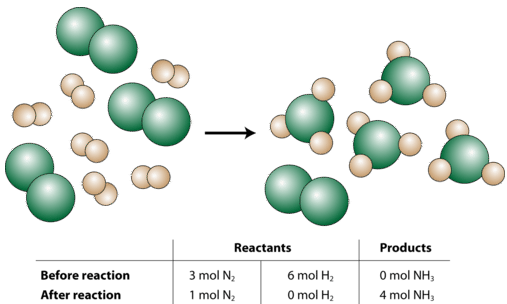
Entonces, ¿qué pasó en esta reacción? El químico inició con 3 moles de\(\ce{N_2}\). Puedes pensar en esto como ser 3 veces más de lo que requiere la “receta” (la ecuación equilibrada) ya que el coeficiente para el\(\ce{N_2}\) es un 1. No obstante, los 6 moles con los\(\ce{H_2}\) que empezó el químico es sólo dos veces más de lo que requiere la “receta”, ya que el coeficiente para el\(\ce{H_2}\) es un 3 y\(3 \times 2 = 6\). Entonces, una vez completada la reacción, el gas hidrógeno se agotará por completo; mientras que quedará 1 mol de gas nitrógeno sobrante. Finalmente, la reacción producirá 4 moles de\(\ce{NH_3}\) porque eso también es dos veces más que lo que se muestra en la ecuación equilibrada. La reacción general que ocurrió en palabras:
\[2 \: \text{mol} \: \ce{N_2} + 6 \: \text{mol} \: \ce{H_2} \rightarrow 4 \: \text{mol} \: \ce{NH_3}\nonumber \]
Todos los montos se duplican a partir de la ecuación balanceada original.
El reactivo limitante (o reactivo limitante) es el reactivo que determina la cantidad de producto que se puede formar en una reacción química. La reacción continúa hasta que el reactivo limitante se agota completamente. En nuestro ejemplo anterior, el\(\ce{H_2}\) es el reactivo limitante. El reactivo en exceso (o reactivo en exceso) es el reactivo que inicialmente está presente en una cantidad mayor de la que eventualmente reaccionará. En otras palabras, siempre queda un exceso de reactivo después de que se completa la reacción. En el ejemplo anterior, el\(\ce{N_2}\) es el exceso de reactivo.
Resumen
- La cantidad de reactivo limitante determina la cantidad de producto que se formará en una reacción química.
Revisar
- En la reacción de Haber ilustrada anteriormente, ¿cómo sabemos que el hidrógeno es el reactivo limitante?
- ¿Y si sobrara hidrógeno?
- ¿Qué material sería limitante si no quedara hidrógeno o nitrógeno?


