13.1: Teoría molecular cinética
- Page ID
- 70450
¿Cuánto oxígeno hay en este contenedor?
Aproximadamente\(20\%\) de la atmósfera es oxígeno. Este gas es esencial para la vida. En ambientes donde el oxígeno está en bajo suministro, se puede proporcionar desde un tanque. Dado que los gases son muy compresibles, se puede almacenar una gran cantidad de oxígeno en un recipiente relativamente pequeño. Cuando se libera, el volumen se expande y la presión disminuye. El gas está entonces disponible para ventilación bajo presión normal.
Teoría Cinético-Molecular
La teoría cinético-molecular explica los estados de la materia, y se basa en la idea de que la materia está compuesta por partículas diminutas que siempre están en movimiento. Esta teoría ayuda a explicar las propiedades observables y comportamientos de sólidos, líquidos y gases. Sin embargo, la teoría cinético-molecular es más fácil de entender ya que se aplica a los gases, y es con los gases que comenzaremos nuestro estudio detallado. La teoría se aplica específicamente a un modelo de gas llamado gas ideal. Un gas ideal es un gas imaginario cuyo comportamiento se ajusta perfectamente a todos los supuestos de la teoría cinético-molecular. En realidad, los gases no son ideales, pero están muy cerca de serlo en la mayoría de las condiciones cotidianas.
La teoría cinético-molecular, tal como se aplica a los gases, tiene cinco supuestos básicos:
- Los gases consisten en un gran número de partículas esféricas diminutas que están muy separadas entre sí en comparación con su tamaño. Las partículas de un gas pueden ser átomos o moléculas. La distancia entre las partículas de un gas es mucho, mucho mayor que la distancia entre las partículas de un líquido o un sólido. La mayor parte del volumen de un gas, por lo tanto, está compuesto por el espacio vacío entre las partículas. De hecho, el volumen de las propias partículas se considera insignificante en comparación con el volumen del espacio vacío.
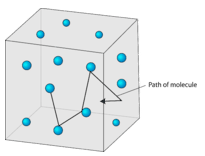
- Las partículas de gas están en constante movimiento rápido en direcciones aleatorias. El rápido movimiento de las partículas de gas les da una cantidad relativamente grande de energía cinética. Recordemos que la energía cinética es la energía que un objeto posee por su movimiento. Las partículas de un gas se mueven en línea recta hasta que chocan con otra partícula, o con una de las paredes del contenedor de gas.
- Las colisiones entre partículas de gas y entre partículas y las paredes del contenedor son colisiones elásticas. Una colisión elástica es aquella en la que no hay pérdida general de energía cinética. La energía cinética puede transferirse de una partícula a otra durante una colisión elástica, pero no hay cambio en la energía total de las partículas colisionantes.
- No hay fuerzas de atracción o repulsión entre las partículas de gas. Las fuerzas atractivas son responsables de que las partículas de un gas real se condensen juntas para formar un líquido. Se supone que las partículas de un gas ideal no tienen fuerzas tan atractivas. El movimiento de cada partícula es completamente independiente del movimiento de todas las demás partículas.
- La energía cinética promedio de las partículas de gas depende de la temperatura del gas. A medida que aumenta la temperatura de una muestra de gas, se incrementan las velocidades de las partículas. Esto da como resultado un incremento en la energía cinética de las partículas. No todas las partículas de gas en una muestra tienen la misma velocidad, por lo que no tienen la misma energía cinética. La temperatura de un gas es proporcional a la energía cinética promedio de las partículas de gas.
Resumen
- Supuestos de la teoría cinético-molecular:
- Los gases consisten en un gran número de partículas esféricas diminutas que están muy separadas entre sí en comparación con su tamaño.
- Las partículas de gas están en constante movimiento rápido en direcciones aleatorias.
- Las colisiones entre partículas de gas y entre partículas y las paredes del contenedor son colisiones elásticas.
- No hay fuerzas de atracción o repulsión entre las partículas de gas.
- La energía cinética promedio de las partículas de gas depende de la temperatura del gas.
Revisar
- Describir el movimiento de las partículas de gas.
- ¿Qué tipo de colisiones ocurren?
- ¿Cuál es la relación entre la energía cinética de las partículas de gas y la temperatura del gas?


