22.2: Reacciones redox y compuestos iónicos
- Page ID
- 70586
El ácido nítrico tiene muchos usos en la fabricación de fertilizantes y explosivos. La mayoría del ácido nítrico se fabrica a partir de amoníaco usando un proceso de tres pasos. El amoníaco se oxida a\(\ce{HNO_3}\) través de la formación de varios óxidos de nitrógeno, resultando finalmente en el ácido.
Reacciones redox y compuestos iónicos
En el curso de una reacción química entre un metal y un no metal, los electrones se transfieren de los átomos metálicos a los átomos no metálicos. Por ejemplo, cuando el zinc metálico se mezcla con azufre y se calienta, se produce el compuesto sulfuro de zinc. Dos electrones de valencia de cada átomo de zinc se transfieren a cada átomo de azufre.
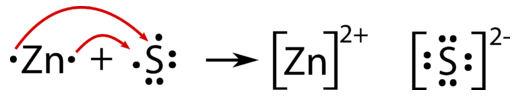
Dado que el zinc está perdiendo electrones en la reacción, se está oxidando. El azufre está ganando electrones y así se está reduciendo. Una reacción de oxidación-reducción es una reacción que implica la transferencia total o parcial de electrones de un reactivo a otro. La oxidación es la pérdida total o parcial de electrones o la ganancia de oxígeno. La reducción es la ganancia total o parcial de electrones o la pérdida de oxígeno. Una reacción redox es otro término para una reacción de oxidación-reducción.
Cada uno de estos procesos se puede mostrar en una ecuación separada llamada media reacción. Una semi-reacción es una ecuación que muestra la reacción de oxidación o reducción que se produce durante una reacción redox.
\[\begin{align*} &\text{Oxidation:} \: \ce{Zn} \rightarrow \ce{Zn^{2+}} + 2 \ce{e^-} \\ &\text{Reduction:} \: \ce{S} + 2 \ce{e^-} \rightarrow \ce{S^{2-}} \end{align*}\nonumber \]
Es importante recordar que las dos medias reacciones ocurren simultáneamente. Los iones resultantes que se forman son luego atraídos entre sí en un enlace iónico.
Otro ejemplo de una reacción de oxidación-reducción que implica transferencia de electrones es la combinación bien conocida de sodio metálico y gas cloro para formar cloruro de sodio:
\[2 \ce{Na} + \ce{Cl_2} \rightarrow 2 \ce{NaCl}\nonumber \]
Las medias reacciones son las siguientes:
\[\begin{align*} &\text{Oxidation:} \: \ce{Na} \rightarrow \ce{Na^+} + \ce{e^-} \\ &\text{Reduction:} \: \ce{Cl} + \ce{e^-} \rightarrow \ce{Cl^-} \end{align*}\nonumber \]
Nos preocuparemos por el equilibrio de estas ecuaciones en otro momento.
Resumen
- Una reacción de oxidación-reducción, o reacción redox, es una reacción que implica la transferencia total o parcial de electrones de un reactivo a otro.
- La oxidación es la pérdida total o parcial de electrones o la ganancia de oxígeno.
- La reducción es la ganancia total o parcial de electrones o la pérdida de oxígeno.
- Una semi-reacción es una ecuación que muestra la reacción de oxidación o reducción que se produce durante una reacción redox.
- Se muestran ejemplos de reacciones de oxidación-reducción.

