22.4: Reacciones Redox Moleculares
- Page ID
- 70589
La acetona es un químico versátil utilizado tanto en la fabricación de plásticos como como solvente. Es un componente importante de productos tales como removedor de esmalte de uñas, pinturas y líquidos de limpieza. La fabricación de acetona implica la formación de un compuesto peróxido intermedio por oxidación, seguido de la formación del producto final.
Reacciones Redox Moleculares
La pérdida y ganancia de electrones es fácil de ver en una reacción en la que se forman iones. Sin embargo, en muchas reacciones, no se produce tal transferencia de electrones. En un compuesto molecular, los electrones se comparten entre átomos en un tipo de enlace llamado enlace covalente. Sin embargo, todavía es común que las reacciones que involucran compuestos moleculares se clasifiquen como reacciones redox.
Cuando se hace reaccionar gas hidrógeno con gas oxígeno, se forma agua como producto.
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O} \left( l \right)\nonumber \]
En las moléculas de hidrógeno individuales, un par de electrones de enlace se comparten por igual entre los átomos de hidrógeno (un enlace covalente no polar). Asimismo, los electrones de enlace en la molécula de oxígeno también se comparten por igual entre los dos átomos de oxígeno. Sin embargo, cuando los átomos se reordenan para formar la molécula de agua, el intercambio de electrones ya no es igual. En cada enlace hidrógeno-oxígeno en la molécula de agua, los electrones de enlace son más atraídos por el átomo de oxígeno que por el átomo de hidrógeno. Esto lo sabemos porque el oxígeno tiene una electronegatividad mayor que el hidrógeno.
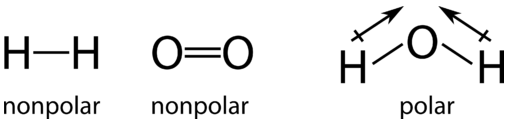
En el transcurso de esta reacción, los electrones se desplazan alejándose de cada átomo de hidrógeno y hacia el átomo de oxígeno. El hidrógeno se oxida porque sufre una pérdida parcial de electrones. A pesar de que la pérdida no es lo suficientemente completa como para formar iones, los átomos de hidrógeno en el agua tienen menos densidad de electrones cerca de ellos que en la\(\ce{H_2}\) molécula. El oxígeno se reduce porque sufre una ganancia parcial de electrones. El átomo de oxígeno en el agua tiene mayor densidad electrónica aquí que en la\(\ce{O_2}\) molécula.
Otra aproximación a este tipo de problemas es volver a nuestras definiciones anteriores de oxidación siendo ganancia de oxígeno o pérdida de hidrógeno, y reducción siendo ganancia de hidrógeno o pérdida de oxígeno. Esto facilita mucho la decisión sobre las reacciones redox. El hidrógeno se oxida porque agregó hidrógeno para formar agua. Por el contrario, el oxígeno se reduce porque agregó hidrógeno para formar agua.

