22.9: Equilibrio de las Reacciones Redox- Método de Cambio del Número de
- Page ID
- 70590
El ácido sulfúrico se produce en cantidades extremadamente grandes en Estados Unidos (alrededor de 40 millones de toneladas/año). Este material se fabrica oxidando azufre para formar trióxido de azufre. Luego\(\ce{SO_3}\) se disuelve en agua para formar el ácido sulfúrico. La mayor parte del ácido sulfúrico producido se utiliza en fertilizantes. Este ácido también se encuentra en las baterías de plomo-ácido para automóviles.
Equilibrar las reacciones redox: método de oxidación-cambio de número
Una forma de equilibrar las reacciones redox es realizar un seguimiento de la transferencia de electrones, utilizando los números de oxidación de cada uno de los átomos. Para el método de oxidación-número-cambio, comience con la ecuación del esqueleto desequilibrado. El siguiente ejemplo es para la reacción del óxido de hierro (II) con monóxido de carbono. Esta reacción es aquella que tiene lugar en un alto horno durante el procesamiento del mineral de hierro en hierro metálico:
\[\ce{Fe_2O_3} \left( s \right) + \ce{CO} \left( g \right) \rightarrow \ce{Fe} \left( s \right) + \ce{CO_2} \left( g \right)\nonumber \]
\[\overset{+3}{\ce{Fe_2}} \overset{-2}{\ce{O_3}} \left( s \right) + \overset{+2}{\ce{C}} \overset{-2}{\ce{O}} \left( g \right) \rightarrow \overset{0}{\ce{Fe}} \left( s \right) + \overset{+4}{\ce{C}} \overset{-2}{\ce{O_2}} \left( g \right)\nonumber \]

El número de oxidación del átomo de carbono aumenta en 2, mientras que el número de oxidación del átomo de hierro disminuye en 3. Según está escrito, el número de electrones perdidos no es igual al número de electrones ganados. En una ecuación redox equilibrada, estos deben ser iguales. Entonces, el incremento en el número de oxidación de un átomo debe hacerse igual a la disminución en el número de oxidación del otro.
Paso 4: Utilizar coeficientes para hacer que el incremento total en el número de oxidación sea igual a la disminución total del número de oxidación. En este caso, el múltiplo menos común de 2 y 3 es 6. Por lo que el aumento del número de oxidación se debe multiplicar por 3, mientras que la disminución del número de oxidación se debe multiplicar por 2. El coeficiente también se aplica a las fórmulas de la ecuación. Por lo que se coloca un 3 frente a la\(\ce{CO}\) y frente a la\(\ce{CO_2}\). Un 2 se coloca delante del\(\ce{Fe}\) en el lado derecho de la ecuación. El\(\ce{Fe_2O_3}\) no requiere un coeficiente porque el subíndice de 2 después del\(\ce{Fe}\) indica que ya hay dos átomos de hierro.
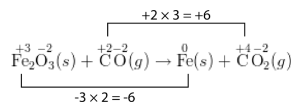
Paso 5: Verifique el equilibrio tanto de átomos como de carga. Ocasionalmente, puede ser necesario colocar un coeficiente frente a una fórmula molecular que no estuvo involucrada en el proceso redox. En el ejemplo actual, la ecuación ahora está equilibrada.
\[\ce{Fe_2O_3} \left( s \right) + 3 \ce{CO} \left( g \right) \rightarrow 2 \ce{Fe} \left( s \right) + 3 \ce{CO_2} \left( g \right)\nonumber \]


