23.11: Galvanoplastia
- Page ID
- 70435
El astrolabio fue un dispositivo utilizado para estudiar los movimientos de los planetas y para hacer topografía; la mayoría estaban hechos de latón. Los místicos persas también utilizaron astrolabio para seguir las estrellas y hacer predicciones astrológicas.
Galvanoplastia
Muchos objetos decorativos, como joyas, se fabrican con la ayuda de un proceso electrolítico. La galvanoplastia es un proceso en el que un ion metálico se reduce en una celda electrolítica y el metal sólido se deposita sobre una superficie. La siguiente figura muestra una celda en la que el cobre metálico se va a chapar sobre un segundo metal.
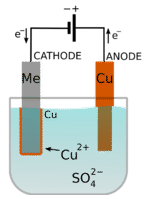
La celda consiste en una solución de sulfato de cobre y una tira de cobre que actúa como ánodo. El metal\(\left( \ce{Me} \right)\) es el cátodo. El ánodo está conectado al electrodo positivo de una batería, mientras que el metal está conectado al electrodo negativo.
Cuando el circuito está cerrado, el cobre metálico del ánodo se oxida, permitiendo que los iones de cobre entren en la solución.
\[\text{anode:} \: \: \: \ce{Cu^0} \left( s \right) \rightarrow \ce{Cu^{2+}} \left( aq \right) + 2 \ce{e^-}\nonumber \]
Mientras tanto, los iones de cobre de la solución se reducen a cobre metálico en la superficie del cátodo (el segundo metal):
\[\text{cathode:} \: \: \: \ce{Cu^{2+}} \left( aq \right) + 2 \ce{e^-} \rightarrow \ce{Cu^0} \left( s \right)\nonumber \]
La concentración de iones cobre en la solución es efectivamente constante. Esto se debe a que el proceso de galvanoplastia transfiere metal del ánodo al cátodo de la celda. Otros metales comúnmente chapados sobre objetos incluyen cromo, oro, plata y platino.

