4.4: Ecuaciones iónicas - Una mirada más cercana
- Page ID
- 74959
- Escribir ecuaciones iónicas para reacciones químicas entre compuestos iónicos.
- Escribir ecuaciones iónicas netas para reacciones químicas entre compuestos iónicos.
Para reacciones de reemplazo simple y doble reemplazo, muchas de las reacciones incluyeron compuestos iónicos, compuestos entre metales y no metales, o compuestos que contenían iones poliatómicos reconocibles. Ahora, echamos un vistazo más de cerca a las reacciones que incluyen compuestos iónicos.
Un aspecto importante sobre los compuestos iónicos que difiere de los compuestos moleculares tiene que ver con la disolución en un líquido, como el agua. Cuando los compuestos moleculares, como el azúcar, se disuelven en agua, las moléculas individuales se separan entre sí. Cuando los compuestos iónicos se disuelven, los iones se separan físicamente entre sí. Podemos usar una ecuación química para representar este proceso, por ejemplo, con NaCl:
\[\ce{ NaCl(s) ->[\ce{H2O}] Na^{+}(aq) + Cl^{-}(aq)}\nonumber \]
Cuando el NaCl se disuelve en agua, los iones se separan y siguen su propio camino en solución; los iones ahora se escriben con sus respectivas cargas, y la etiqueta de fase (ac) enfatiza que se disuelven (Figura\(\PageIndex{1}\)). Este proceso se llama disociación; decimos que los iones se disocian.
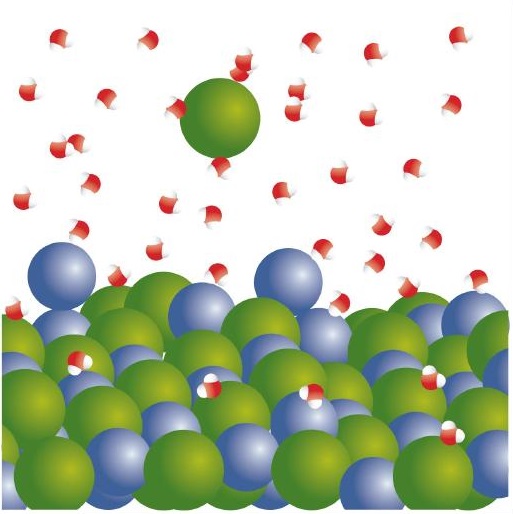
Todos los compuestos iónicos que se disuelven se comportan así. Este comportamiento fue sugerido por primera vez por el químico sueco Svante August Arrhenius [1859—1927] como parte de su tesis doctoral en 1884. Curiosamente, a su equipo de exámenes de doctorado le costó creer que los compuestos iónicos se comportarían así, por lo que le dieron a Arrhenius una calificación apenas aprobatoria. Posteriormente, esta obra fue citada cuando Arrhenius fue galardonado con el Premio Nobel de Química. Ten en cuenta que cuando los iones se separan, todos los iones se separan. Así, cuando CaCl 2 se disuelve, un ion Ca 2 + y los dos iones Cl − se separan entre sí:
\[CaCl_{2}(s)\overset{H_{2}O}{\rightarrow}Ca^{2+}(aq)+Cl^{-}(aq)+Cl^{-}(aq)\nonumber \]
\[CaCl_{2}(s)\overset{H_{2}O}{\rightarrow}Ca^{2+}(aq)+2Cl^{-}(aq)\nonumber \]
Es decir, los dos iones cloruro se apagan solos. No permanecen como Cl 2 (eso sería cloro elemental; estos son iones cloruro), y no se pegan entre sí para hacer Cl 2 − o Cl 2 2 −. Se convierten en iones disociados por derecho propio. Los iones poliatómicos también conservan su identidad general cuando se disuelven.
Escribe la ecuación química que representa la disociación de cada compuesto iónico.
- KBr
- Na 2 SO 4
Solución
- KBr (s) → K + (aq) + Br − (aq)
- No solo los dos iones de sodio siguen su propio camino, sino que el ion sulfato permanece unido como el ion sulfato. La ecuación de disolución es Na 2 SO 4 (s) → 2Na + (aq) + SO 4 2 − (aq)
Escribe la ecuación química que representa la disociación de (NH 4) 2 S.
- Responder
-
(NH 4) 2 S (s) → 2NH 4 + (aq) + S 2− (aq)
Cuando los químicos en solución reaccionan, la forma correcta de escribir las fórmulas químicas de los compuestos iónicos disueltos es en términos de los iones disociados, no la fórmula iónica completa. Una ecuación iónica completa es una ecuación química en la que los compuestos iónicos disueltos se escriben como iones separados. Las reglas de solubilidad son muy útiles para determinar qué compuestos iónicos se disuelven y cuáles no. Por ejemplo, cuando NaCl (ac) reacciona con AgnO 3 (ac) en una reacción de doble reemplazo para precipitar AgCl (s) y formar NaN3 (ac), la ecuación iónica completa incluye NaCl, AgnO 3 y NaN 3 escritos como iones separados:
\[\ce{Na^{+}(aq) + Cl^{−}(aq) + Ag^{+}(aq) + NO3^{−}(aq) → AgCl(s) + Na^{+}(aq) + NO3^{−}(aq)}\nonumber \]
Esto es más representativo de lo que está ocurriendo en la solución.
Escriba la ecuación iónica completa para cada reacción química.
- KBr (aq) + AgC 2 H 3 O 2 (aq) → KC 2 H 3 O 2 (aq) + AgBr (s)
- MgSO 4 (ac) + Ba (NO 3) 2 (aq) → Mg (NO 3) 2 (aq) + BasO 4 (s)
Solución
Para cualquier compuesto iónico que sea acuoso, escribiremos el compuesto como iones separados.
- La ecuación iónica completa es K + (aq) + Br − (aq) + Ag + (aq) + C 2 H 3 O 2 − (aq) → K + (aq) + C 2 H 3 O 2 − (aq) + AgBr (s)
- La ecuación iónica completa es Mg 2 + (aq) + SO 4 2 − (aq) + Ba 2 + (aq) + 2NO 3 − (aq) → Mg 2 + (aq) + 2NO 3 − (aq) + BasO 4 (s)
Escribe la ecuación iónica completa para
\[\ce{CaCl2(aq) + Pb(NO3)2(aq) → Ca(NO3)2(aq) + PbCl2(s)}\nonumber \]
- Responder
-
Ca 2 + (aq) + 2Cl − (aq) + Pb 2 + (aq) + 2NO 3 − (aq) → Ca 2 + (aq) + 2NO 3 − (aq) + PbCl 2 (s)
Puede notar que en una ecuación iónica completa, algunos iones no cambian su forma química; permanecen exactamente iguales en los lados del reactivo y del producto de la ecuación. Por ejemplo, en
Na + (aq) + Cl − (aq) + Ag + (aq) + NO 3 − (aq) → AgCl (s) + Na + (aq) + NO 3 − (aq)
los iones Ag + (aq) y Cl − (aq) se convierten en AgCl (s), pero los iones Na + (aq) y los iones NO 3 − (ac) permanecen como iones Na + (ac) y NO 3 iones − (aq). Estos dos iones son ejemplos de iones espectadores—iones que no hacen nada en el curso general de una reacción química. Están presentes, pero no participan en la química general. Es común cancelar iones de espectador (algo que también se hace con cantidades algebraicas) en los lados opuestos de una ecuación química:
\[\cancel{Na^{+}(aq)}+Cl^{-}(aq)+Ag^{+}(aq)+\cancel{NO_{3}^{-}}(aq)\rightarrow AgCl(s)+\cancel{Na}^{+}(aq)+\cancel{NO}_{3}^{-}(aq)\nonumber \]
Lo que queda cuando se eliminan los iones del espectador se llama ecuación iónica neta, que representa el cambio químico real que ocurre entre los compuestos iónicos:
Cl − (aq) + Ag + (aq) → AgCl (s)
Es importante reiterar que los iones del espectador siguen presentes en solución, pero no experimentan ningún cambio químico neto, por lo que no están escritos en una ecuación iónica neta.
Escriba la ecuación neta iónica para cada reacción química.
- K + (aq) + Br − (aq) + Ag + (aq) + C 2 H 3 O 2 − (aq) → K + (aq) + C 2 H 3 O 2 − (aq) + AgBr (s)
- Mg 2 + (aq) + SO 4 2 − (aq) + Ba 2 + (aq) + 2NO 3 − (aq) → Mg 2 + (aq) + 2NO 3 − (aq) + BasO 4 (s)
Solución
- En la primera ecuación, los iones K + (aq) y C 2 H 3 O 2 − (aq) son iones de espectador, por lo que se cancelan:
\[\cancel{K^{+}(aq)}+Br^{-}(aq)+Ag^{+}(aq)+\cancel{C_{2}H_{3}O_{2}^{-}(aq)}\rightarrow K^{+}(aq)+\cancel{C_{2}H_{3}O_{2}^{-}(aq)}+AgBr(s)\nonumber \]
La ecuación iónica neta es
Br − (aq) + Ag + (aq) → AgBr (s)
- En la segunda ecuación, los iones Mg 2 + (aq) y NO 3 − (aq) son iones de espectador, por lo que se cancelan:
\[\cancel{Mg^{2+}(aq)}+SO_{4}^{2-}(aq)+Ba^{2+}(aq)+\cancel{2NO_{3}^{-}(aq)}\rightarrow Mg^{2+}(aq)+\cancel{2NO_{3}^{-}(aq)}+BaSo_{4}(s)\nonumber \]
La ecuación iónica neta es
SO 4 2 − (aq) + Ba 2 + (aq) → BasO 4 (s)
Escribe la ecuación neta iónica para
CaCl 2 (aq) + Pb (NO 3) 2 (aq) → Ca (NO 3) 2 (aq) + PbCl 2 (s)
- Responder
-
Pb 2 + (aq) + 2Cl − (aq) → PbCl 2 (s)
El concepto de solubilidad versus insolubilidad en compuestos iónicos es una cuestión de grado. Algunos compuestos iónicos son muy solubles, algunos son sólo moderadamente solubles, y algunos son tan poco solubles que se consideran insolubles. Para la mayoría de los compuestos iónicos, también hay un límite en la cantidad de compuesto que se puede disolver en una muestra de agua. Por ejemplo, puedes disolver un máximo de 36.0 g de NaCl en 100 g de agua a temperatura ambiente, pero puedes disolver solo 0.00019 g de AgCl en 100 g de agua. Consideramos\(\ce{NaCl}\) solubles pero\(\ce{AgCl}\) insolubles.
Un lugar donde la solubilidad es importante es en el calentador de agua tipo tanque que se encuentra en muchos hogares en los Estados Unidos. El agua doméstica frecuentemente contiene pequeñas cantidades de compuestos iónicos disueltos, incluido el carbonato de calcio (CaCo 3). Sin embargo, CaCo 3 tiene la propiedad relativamente inusual de ser menos soluble en agua caliente que en agua fría. Entonces como el calentador de agua opera calentando agua, CaCo 3 puede precipitar si hay suficiente en el agua. Este precipitado, llamado cal, también puede contener compuestos de magnesio, compuestos de hidrogenocarbonato y compuestos de fosfato. El problema es que demasiada cal puede impedir la función de un calentador de agua, requiriendo más energía para calentar el agua a una temperatura específica o incluso bloquear las tuberías de agua dentro o fuera del calentador de agua, causando disfunción.

Otro lugar donde la solubilidad versus insolubilidad es un problema es el Gran Cañón. Normalmente pensamos en la roca como insoluble. Pero en realidad es siempre tan ligeramente soluble. Esto quiere decir que en un periodo de unos dos mil millones de años, el río Colorado talló roca de la superficie disolviéndola lentamente, generando finalmente una espectacular serie de gargantas y cañones. ¡Y todo por la solubilidad!

Claves para llevar
- Los compuestos iónicos que se disuelven se separan en iones individuales.
- Las ecuaciones iónicas completas muestran sólidos iónicos disueltos como iones separados.
- Las ecuaciones iónicas netas muestran solo los iones y otras sustancias que cambian en una reacción química.


