3.1: La electricidad y el átomo
- Page ID
- 72255
- Comprender el significado de los experimentos realizados por Thomson y Millikan.
Alessandro Giuseppe Antonio Anastasio Volta (1745—1827) fue un físico, químico italiano y pionero de la electricidad y el poder; a quien se le atribuye como el inventor de la batería eléctrica y el descubridor del metano. Inventó la pila voltaica en 1799; con esta invención, Volta demostró que la electricidad se podía generar químicamente, y desacreditó la teoría predominante de que la electricidad era generada únicamente por seres vivos. La invención de Volta desató una gran cantidad de entusiasmo científico y llevó a otros a realizar experimentos similares, lo que finalmente condujo al desarrollo del campo de la electroquímica.
Electrólisis
Sir Humphry Davy, primer baronet (1778—1829) fue un químico e inventor de Cornualles. Fue pionero en el campo de la electrólisis, que utiliza la pila voltaica para dividir compuestos comunes y así preparar muchos elementos nuevos. Luego procedió a electrolizar sales fundidas y descubrió varios metales nuevos, entre ellos el sodio y el potasio en 1807. Al año siguiente, descubrió calcio, estroncio, bario, magnesio y boro, así como la naturaleza elemental del cloro y el yodo. También estudió las fuerzas involucradas en estas separaciones, inventando el nuevo campo de la electroquímica.
El asistente de laboratorio de Davy, Michael Faraday, continuó mejorando el trabajo de Davy y se convertiría en el científico más famoso e influyente. Se supone que Davy incluso reclamó a Faraday como su mayor descubrimiento. Faraday (1791-1867) fue un científico inglés que contribuyó al estudio del electromagnetismo y la electroquímica. Sus principales descubrimientos incluyen los principios subyacentes a la inducción electromagnética, el diamagnetismo y la electrólisis.
Como químico, Faraday descubrió benceno, investigó el hidrato de clatrato del cloro, inventó una forma temprana del quemador Bunsen y el sistema de números de oxidación, y popularizó terminología como “ánodo”, “cátodo”, “electrodo” e “ion”. Faraday finalmente se convirtió en el primer y principal profesor Fulleriano de Química en la Royal Institution, un puesto de por vida. Su trabajo sobre electrólisis allanó el camino para experimentos posteriores realizados con tubos de rayos catódicos.
Tubos de rayos catódicos
El televisor que se ve a continuación es cada vez más difícil de encontrar en estos días. La razón principal es porque son más antiguos y se basan en tecnología anticuada. Los nuevos televisores son tecnología de pantalla plana que ocupan menos espacio y dan una mejor calidad de imagen, sobre todo con la llegada de la radiodifusión de alta definición. La tecnología utilizada en los televisores más antiguos utilizaba tubos de rayos catódicos. Un haz de electrones fue rociado a un tubo de imagen el cual fue tratado para reaccionar con los electrones para producir una imagen. Dispositivos similares de CRT (tubo de rayos catódicos) se utilizaron en monitores de computadora, ahora también reemplazados por monitores de pantalla plana.

El primer prototipo de tubo de rayos catódicos fue desarrollado por Heinrich Geissler, un soplador de vidrio y físico alemán. Utilizó una bomba de mercurio para crear un vacío en un tubo. Geissler exploró una serie de técnicas para eliminar el aire del tubo y evitar fugas, así como formas de obtener buenas conexiones de los cables en los tubos. En 1878, Sir William Crookes, un científico británico, exhibió los primeros rayos catódicos utilizando una modificación del aparato Geissler. Su mayor contribución a la construcción del tubo fue desarrollar formas de evacuar casi todo el aire del tubo. Crookes también realizó muchos experimentos utilizando equipos más confiables para confirmar hallazgos anteriores sobre las propiedades de los rayos catódicos. Descubrió dos cosas que apoyaban la hipótesis de que el rayo catódico consistía en una corriente de partículas.
- Cuando se colocó un objeto entre el cátodo y el extremo opuesto del tubo, proyectaba una sombra sobre el vidrio. La sombra causada por el objeto indica que las partículas estaban siendo bloqueadas en su camino desde el cátodo hasta el ánodo.
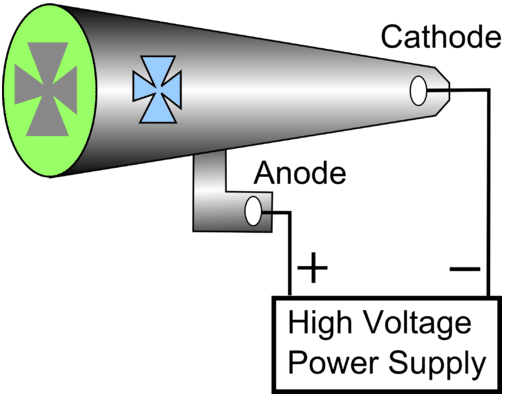
- Se construyó un tubo de rayos catódicos con un pequeño riel metálico entre los dos electrodos. Adherida al riel había una rueda de paletas capaz de girar a lo largo del riel. Al arrancar el tubo de rayos catódicos, la rueda giró desde el cátodo hacia el ánodo. Observe que el cátodo y el ánodo están posicionados de manera que los rayos golpeen la parte superior de la rueda de paletas. Crookes concluyó que el rayo catódico estaba hecho de partículas las cuales deben tener masa.

El tubo de rayos catódicos fue inventado por primera vez por Sir William Crookes.
Más investigación con el tubo de Crookes
El trabajo de Crookes abrió la puerta a una serie de descubrimientos importantes. Otros científicos pudieron demostrar que el “rayo catódico” era en realidad una corriente de electrones. En 1897, Karl Ferdinand Braun desarrolló el primer osciloscopio, utilizando un tubo de rayos catódicos para ver un pulso eléctrico a medida que pasaba por el instrumento. La invención de la televisión no habría sido posible sin el tubo de rayos catódicos. El trabajo con un sistema modificado condujo al descubrimiento de radiografías en 1895 por el físico alemán Wilhelm Roentgen. Este sencillo dispositivo ha dado lugar a importantes avances en ciencia y tecnología.
Experimento de Thomson: Relación de masa a carga
En 1897, el físico británico J. J. Thomson (1856—1940) demostró que los átomos no eran la forma más básica de la materia. Demostró que los rayos catódicos podían ser desviados, o doblados, por campos magnéticos o eléctricos, lo que indicaba que los rayos catódicos consisten en partículas cargadas (Figura 1.17c). Más importante aún, al medir la extensión de la deflexión de los rayos catódicos en campos magnéticos o eléctricos de diversas intensidades, Thomson pudo calcular la relación masa/carga de las partículas. Estas partículas fueron emitidas por el cátodo cargado negativamente y repelidas por el terminal negativo de un campo eléctrico. Debido a que las cargas similares se repelen entre sí y las cargas opuestas se atraen, Thomson concluyó que las partículas tenían una carga neta negativa; estas partículas ahora se llaman electrones. Más relevante para el campo de la química, Thomson encontró que la relación masa-carga de los rayos catódicos es independiente de la naturaleza de los electrodos metálicos o del gas, lo que sugiere que los electrones son componentes fundamentales de todos los átomos.
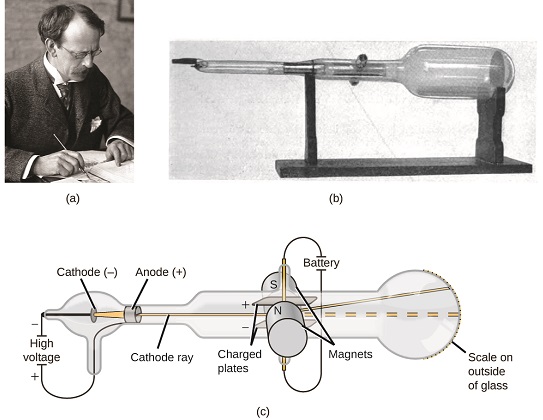
Tubo de rayos catódicos
Video\(\PageIndex{1}\) Un tubo de rayos catódicos.
Video\(\PageIndex{2}\) Video de Davidson College demostrando el experimento e/m de Thompson. También puedes usar un applet del Google Group Physics Flash para simular el experimento y aquí hay otro applet, de Kings Center for Visual Exploration en Alberta (KCVE) con una explicación detallada
Experimento de caída de aceite de Millikan: carga de electrones
En 1909, más información sobre el electrón fue descubierta por el físico estadounidense Robert A. Millikan a través de sus experimentos de “gotas de petróleo”. Millikan creó gotitas microscópicas de aceite, que podrían cargarse eléctricamente por fricción a medida que se formaban o mediante el uso de rayos X. Estas gotitas cayeron inicialmente debido a la gravedad, pero su avance hacia abajo podría ser ralentizado o incluso revertido por un campo eléctrico más bajo en el aparato. Al ajustar la intensidad del campo eléctrico y realizar mediciones cuidadosas y cálculos apropiados, Millikan pudo determinar la carga en gotas individuales (Figura\(\PageIndex{2}\)).
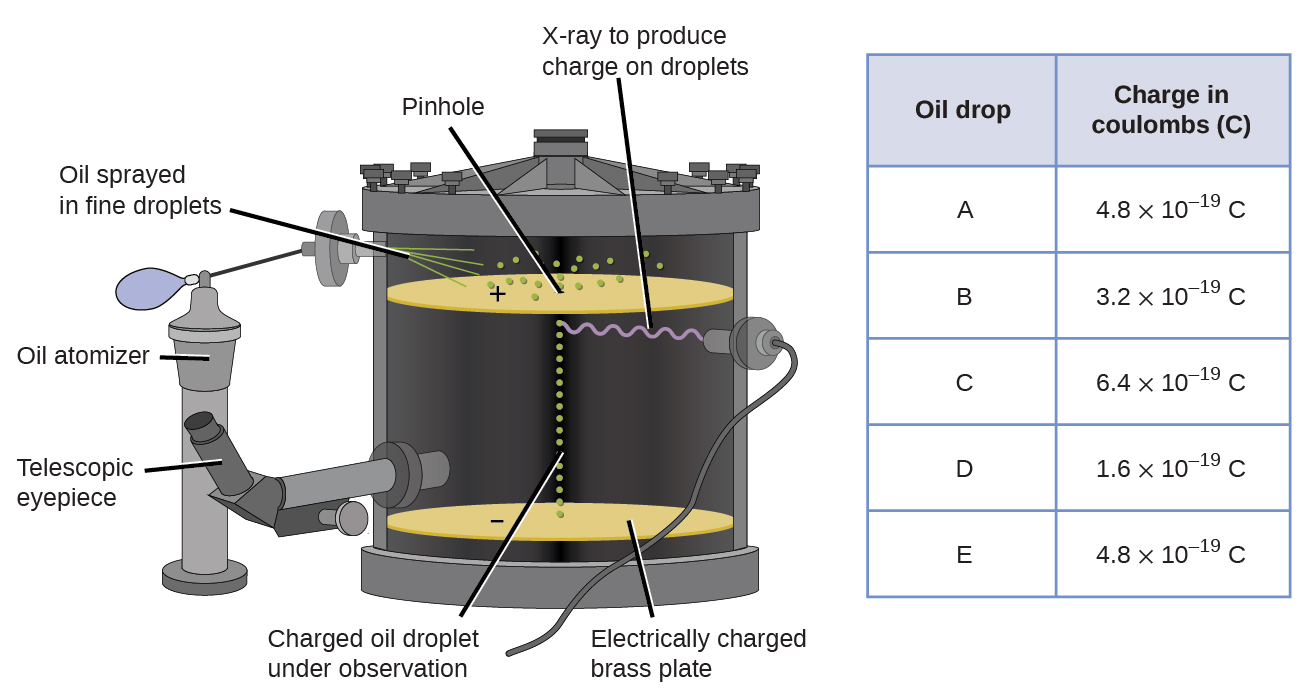
Luego concluyó que la carga de un solo electrón es 1.6\(\times\) 10 −19 C. Con esta información y la relación masa-carga de Thomson (1.759\(\times\) 10 11 C/kg)., Millikan determinó la masa de un electrón:
\[Mass\: of\: electron = {charge}\times \dfrac {mass}{charge} \nonumber \]
\[\mathrm{=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{3.1.2} \]
Los científicos ya habían establecido que el átomo no era indivisible como Dalton había creído, y debido al trabajo de Thomson, Millikan y otros, se conocía la carga y masa de las partículas subatómicas negativas, los electrones. Sin embargo, la parte cargada positivamente de un átomo aún no se entendía bien.
Resumen
- El tubo de rayos catódicos fue inventado por primera vez por Sir William Crookes.
- Los experimentos mostraron que los rayos tenían masa.
- El tubo de rayos catódicos de Thomson mostró que los átomos contienen partículas pequeñas con carga negativa llamadas electrones.
- Millikan descubrió que existe una carga eléctrica fundamental: la carga de un electrón.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- Wikipedia

