12.2: Los silicatos y las formas de las cosas
- Page ID
- 72527
- Describir diferentes tipos de minerales a base de silicato.
Los silicatos son los más grandes, los más interesantes y la clase de minerales más complicada que cualquier otro mineral. Aproximadamente 30% de todos los minerales son silicatos y algunos geólogos estiman que 90% de la corteza terrestre está compuesta por silicatos, material a base de SiO 4 -. Así, el oxígeno y el silicio son los dos elementos más abundantes en la corteza terrestre.
El bloque de construcción de todos estos minerales es el tetraedro de sílice, una combinación de cuatro átomos de oxígeno y un átomo de silicio. Como hemos visto, se le llama tetraedro porque los planos dibujados a través de los átomos de oxígeno forman una forma con 4 superficies (Figura\(\PageIndex{1}\)). Dado que el ion de silicio tiene una carga de 4 y cada uno de los cuatro iones de oxígeno tiene una carga de −2, el tetraedro de sílice tiene una carga neta de -4.
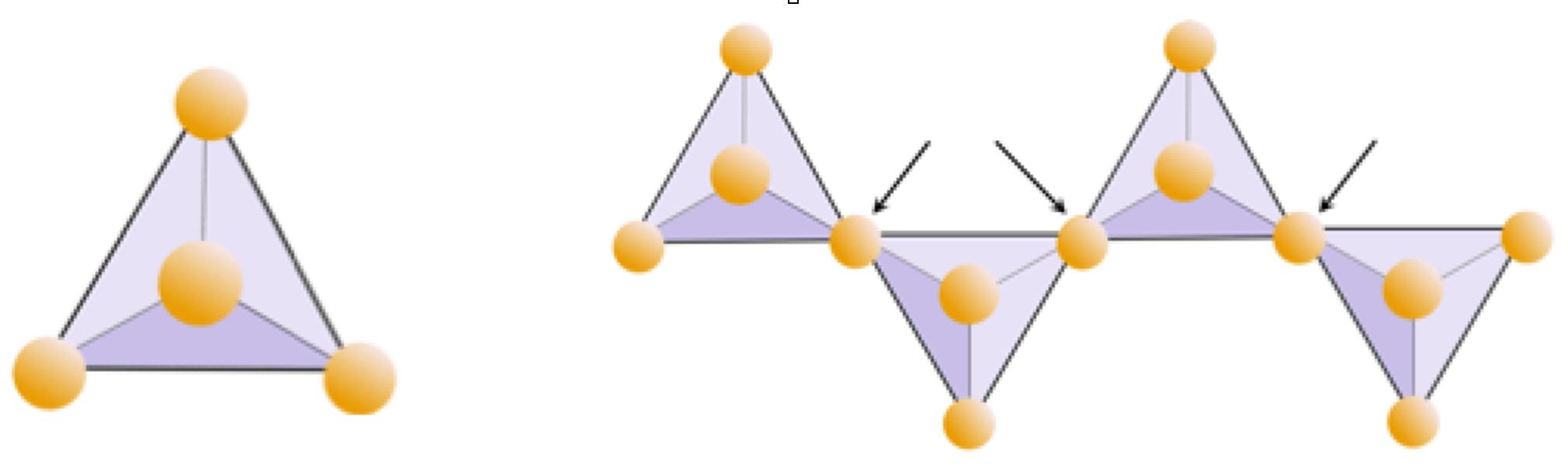
En los minerales de silicato, estos tetraedros están dispuestos y unidos entre sí de diversas maneras, desde unidades individuales hasta marcos complejos (Tabla\(\PageIndex{1}\)).
| Imagen de configuración de tetraedro | Nombre de configuración del tetraedro | Ejemplo Minerales |
|---|---|---|
 |
Aislados (nesosilicatos) | Olivino, granate, circón, cianita |
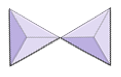 |
Pares (sorosilicatos) | Epidota, zoisita |
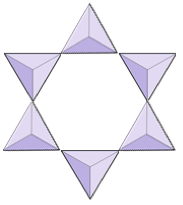 |
Anillos (ciclosilicatos) | Turmalina |
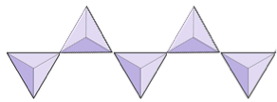 |
Cadenas simples (inosilicatos) | Piroxenos, wollastonita |
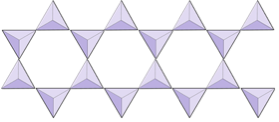 |
Cadenas dobles (inosilicatos) | Anfíboles |
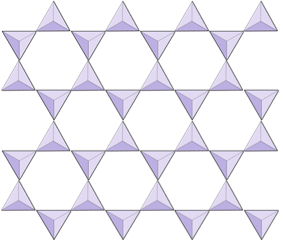 |
Hojas (filosilicatos) | Micas, minerales arcillosos, serpentina, clorito |
| Estructura tridimensional | Marco (tectosilicatos) | Feldespatos, cuarzo, zeolita |
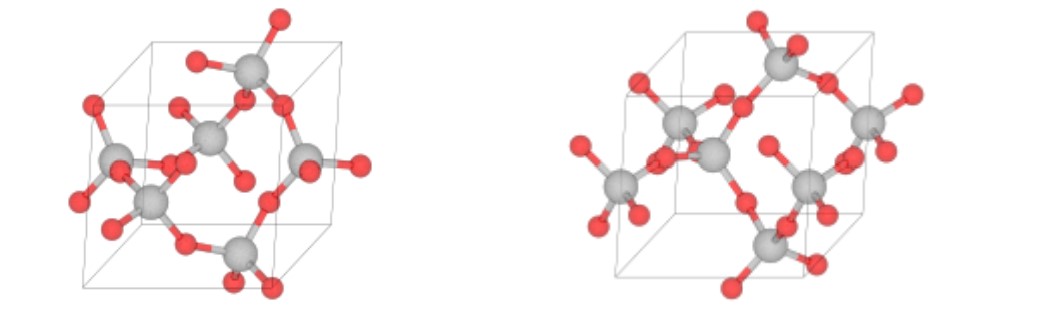
En el caso extremo, los tetraedros están dispuestos de manera regular y ordenada formando una red tridimensional. El cuarzo es tal estructura (Figura\(\PageIndex{2}\)), y su fórmula es SiO 2. Si la sílice en estado fundido se enfría muy lentamente cristaliza en el punto de congelación. Pero si la sílice fundida se enfría más rápidamente, el sólido resultante es una disposición desordenada que se llama vidrio, a menudo también llamado cuarzo.
Los silicatos son materiales extremadamente importantes, tanto naturales (como granito, grava y granate) como artificiales (como cemento Portland, cerámica, vidrio y vidrio de agua), para todo tipo de actividades tecnológicas y artísticas. Fuente: Wikipedia
Gafas
El vidrio es un sólido amorfo no cristalino, a menudo transparente, que tiene un uso práctico, tecnológico y decorativo generalizado en, por ejemplo, cristales de ventanas, vajillas, óptica y optoelectrónica. Los tipos de vidrio manufacturados más familiares e históricamente los más antiguos son los “vidrios de silicato” basados en el compuesto químico sílice (dióxido de silicio o cuarzo), el constituyente principal de la arena. El término vidrio, en uso popular, a menudo se usa para referirse solo a este tipo de material, que es familiar por su uso como vidrio de ventana y botellas de vidrio. De los muchos vidrios a base de sílice que existen, el vidriado ordinario y el vidrio contenedor se forma a partir de un tipo específico llamado vidrio de soda-cal, compuesto de aproximadamente 75% de dióxido de silicio (SiO 2), óxido de sodio (Na 2 O) a partir de carbonato de sodio (Na 2 CO 3), óxido de calcio ( CaO), también llamada cal, y varios aditivos menores.
En la tabla se\(\PageIndex{2}\) enumeran los tipos más comunes de vidrios de silicato y sus ingredientes, propiedades y aplicaciones. La figura\(\PageIndex{3}\) son ejemplos de vidrios de silicato.
| Tipo y Propiedades | Ingredientes clave | Aplicaciones |
| El cuarzo fundido tiene muy baja expansión térmica y excelente resistencia al choque térmico, pudiendo sobrevivir a la inmersión en agua al rojo vivo, resiste altas temperaturas (1000—1500 °C) y a la intemperie química, y es muy duro. | Sílice químicamente pura (dióxido de silicio) | Se utiliza para aplicaciones de alta temperatura como tubos de horno, tubos de iluminación, crisoles de fusión, etc. |
| El vidrio de soda-cal-sílice es transparente, se forma fácilmente y es el más adecuado para vidrio de ventana y vajilla. [68] Sin embargo, tiene una alta expansión térmica y poca resistencia al calor. | (Na 2 O) + cal (CaO) + magnesia (MgO) + alúmina (Al 2 O 3) representan más del 75% del vidrio manufacturado, conteniendo aproximadamente 70 a 74% de sílice en peso | Normalmente se usa para ventanas, botellas, bombillas y frascos. [ |
| Los vidrios de borosilicato de sodio tienen coeficientes de expansión térmica bastante bajos (7740 Pyrex CTE es 3.25×10 −6 /°C [69] en comparación con aproximadamente 9×10 −6 /°C para un vidrio típico de soda-cal [70]). Por lo tanto, están menos sujetos al estrés causado por la expansión térmica y, por lo tanto, menos vulnerables al agrietamiento por choque térmico. | 5-13% de trióxido de boro (B 2 O 3) | Comúnmente utilizado para, por ejemplo, labware (por ejemplo, Pyrex, Duran), utensilios de cocina domésticos y faros delanteros de automóviles con viga sellada [ |
| El vidrio de óxido de plomo, vidrio de cristal, vidrio de plomo tiene alta densidad lo que resulta en una alta densidad de electrones, y por lo tanto alto índice de refracción, haciendo que el aspecto de la cristalería sea más brillante y causando notablemente más reflexión especular y mayor dispersión óptica. [61] [72] El vidrio de plomo tiene una alta elasticidad, lo que hace que la cristalería sea más viable y da lugar a un claro sonido de “anillo” cuando se golpean. | sílice + óxido de plomo (PbO) + óxido de potasio (K 2 O) + sosa (Na 2 O) + óxido de zinc (ZnO) + alúmina | Se utiliza para vajilla, objetos de arte, vidrio óptico. |
| El vidrio de aluminosilicato tiende a ser más difícil de fundir y dar forma en comparación con las composiciones de borosilicato, pero tiene una excelente resistencia térmica y durabilidad. | alúmina y sílice | Ampliamente utilizado para la fibra de vidrio, utilizado para la fabricación de plásticos reforzados con vidrio (barcos, cañas de pescar, etc.), utensilios de cocina para la parte superior de la estufa y vidrio de bombilla |
| El vidrio de óxido de germanio es un vidrio extremadamente transparente. La luz pierde sólo el 5% de su intensidad a través de 1 km de fibra de vidrio. | alúmina + dióxido de germanio (GeO 2). | Utilizado para guías de onda de fibra óptica en redes de comunicación. |
| El vidrio coloreado es vidrio transparente con óxidos añadidos. | Diferentes aditivos de óxido producen los diferentes colores en vidrio: turquesa (óxido de cobre (II)), [121] púrpura (dióxido de manganeso), rojo (sulfuro de cadmio), azul (óxido de cobalto) y verde (óxido de hierro (II) y óxido de cromo (III)). | Se utiliza para vajilla y cristalería decorativa. |



a. b. c.
Figura \(\PageIndex{3}\)Ejemplos de vidrios de silicato: a. taza medidora Pyrex, b. botella de vidrio rojo con recubrimiento de vidrio amarillo, y c. cuenco de vidrio romano de cuatro colores, fabricado alrededor del siglo I a.C..
Asbesto
Amianto es el nombre que se aplica a seis minerales naturales que se extraen de la tierra. Los diferentes tipos de amianto son:
- Amosite
- Crisotilo
- Tremolita
- ActinoliteUnlink
- Antofilita
- Crocidolita
De estos seis, tres se utilizan con mayor frecuencia. El crisotilo (blanco) es el más común, pero no es raro que se encuentre. Amosita (marrón/blanquecino), o Crocidolita (azul) también. El asbesto es material fibroso no inflamable, y se han utilizado para material de aislamiento de terminales, forros de frenos, material de construcción y filtros. Cuando se mezcla con cemento, refuerza la resistencia mecánica del concreto. Se descompone debido a la pérdida de agua, y forma forsterita y sílice a alta temperatura.
Cerámica
Una cerámica es un material sólido que comprende un compuesto inorgánico de enlaces metálicos, no metálicos o iónicos y covalentes. Los ejemplos comunes son loza, porcelana y ladrillo.
La cristalinidad y la composición de electrones variables en los enlaces iónicos y covalentes hacen que la mayoría de los materiales cerámicos sean buenos aislantes térmicos y eléctricos (ampliamente investigados en ingeniería cerámica). Con una gama tan amplia de opciones posibles para la composición/estructura de una cerámica (por ejemplo, casi todos los elementos, casi todos los tipos de unión y todos los niveles de cristalinidad), la amplitud del sujeto es vasta, y los atributos identificables (por ejemplo, dureza, tenacidad, conductividad eléctrica, etc.) son difícil de especificar para el grupo en su conjunto. Propiedades generales como alta temperatura de fusión, alta dureza, mala conductividad, altos módulos de elasticidad, resistencia química y baja ductilidad son la norma, [1] con excepciones conocidas a cada una de estas reglas (por ejemplo, cerámica piezoeléctrica, temperatura de transición vítrea, cerámica superconductora, etc.).
Cemento y Concreto
Un cemento es un aglutinante, una sustancia utilizada para la construcción que fragua, endurece y se adhiere a otros materiales para unirlos. El cemento rara vez se usa solo, sino más bien para unir arena y grava (agregado). El cemento mezclado con agregado fino produce mortero para mampostería, o con arena y grava, produce concreto. El cemento es el material más utilizado en la existencia y solo está detrás del agua como el recurso más consumido del planeta. [1]
Los cementos utilizados en la construcción suelen ser inorgánicos, a menudo a base de cal o silicato de calcio.
El concreto es un material compuesto compuesto de agregado fino y grueso unido junto con un cemento fluido (pasta de cemento) que se endurece con el tiempo, con mayor frecuencia en el pasado un aglutinante de cemento a base de cal, como masilla de cal, pero a veces con otros cementos hidráulicos, como un cemento de aluminato de calcio o con cemento Portland para formar concreto de cemento Portland (por su parecido visual con la piedra Portland). [2] [3] Existen muchos otros tipos de concreto no cementoso con diferentes métodos de unión de agregados, incluido el concreto asfáltico con un aglutinante de betún, que se usa frecuentemente para superficies de carreteras, y hormigones poliméricos que utilizan polímeros como aglutinante.
Resumen
- Los silicatos son los más grandes, los más interesantes y la clase de minerales más complicada que cualquier otro mineral. Aproximadamente el 90% de la corteza terrestre está compuesta por silicatos, material a base de SiO 4 -.
- Los silicatos son materiales extremadamente importantes, tanto naturales (como granito, grava y granate) como artificiales (como cemento Portland, cerámica, vidrio y vidrio de agua), para todo tipo de actividades tecnológicas y artísticas
Colaboradores y Atribuciones
Chung (Peter) Chieh (Chemistry, University of Waterloo)
- Libretext: Physical Geology (Earle)
- Libretext: Inorganic Chemistry
- Wikipedia

