18.4: Químicos contra el Cáncer
- Page ID
- 72445
- Enumerar los diferentes tipos de medicamentos contra el cáncer y su mecanismo de acción.
La quimioterapia es un tipo de tratamiento contra el cáncer que usa uno o más medicamentos anticancerosos (agentes quimioterapéuticos) como parte de un régimen de quimioterapia estandarizado. La quimioterapia se puede administrar con una intención curativa (que casi siempre implica combinaciones de medicamentos), o puede tener como objetivo prolongar la vida o reducir los síntomas (quimioterapia paliativa). La quimioterapia es una de las principales categorías de la disciplina médica dedicada específicamente a la farmacoterapia para el cáncer, que se llama oncología médica.
Al combatir el cáncer, toda la población de células neoplásicas debe ser erradicada para obtener los resultados deseados. El concepto de “muerte celular total” se aplica a la quimioterapia como lo hace a otros medios de tratamiento: la extirpación total del tumor es necesaria para la atención quirúrgica, y se requiere la destrucción completa de todas las células cancerosas para una cura con radioterapia.
Los fármacos anticancerosos disponibles tienen distintos mecanismos de acción que pueden variar en sus efectos sobre diferentes tipos de células normales y cancerosas. Una sola “cura” para el cáncer ha resultado esquiva ya que no hay un solo tipo de cáncer sino hasta 100 tipos diferentes de cáncer. Además, hay muy pocas diferencias bioquímicas demostrables entre células cancerosas y células normales. Por esta razón, la efectividad de muchos fármacos anticancerosos está limitada por su toxicidad para células normales de rápido crecimiento en las áreas intestinal y de médula ósea. Un problema final es que las células cancerosas que inicialmente son suprimidas por un fármaco específico pueden desarrollar una resistencia a ese fármaco. Por esta razón, la quimioterapia contra el cáncer puede consistir en el uso de varios medicamentos en combinación durante diferentes períodos de tiempo.
Introducción
Los medicamentos quimioterapéuticos, a veces son temidos por la preocupación de un paciente por los efectos tóxicos. Su papel es frenar y ojalá detener el crecimiento y la propagación de un cáncer. Hay tres objetivos asociados con el uso de los agentes anticancerosos más utilizados.
- Dañar el ADN de las células cancerosas afectadas.
- Inhibir la síntesis de nuevas cadenas de ADN para evitar que la célula se replique, porque la replicación de la célula es lo que permite que el tumor crezca.
- Detener la mitosis o la división real de la célula original en dos nuevas células. Detener la mitosis detiene la división celular (replicación) del cáncer y, en última instancia, puede detener la progresión del cáncer.
Desafortunadamente, la mayoría de los medicamentos actualmente en el mercado no son específicos, lo que lleva a los muchos efectos secundarios comunes asociados con la quimioterapia contra el cáncer. Debido a que el enfoque común de toda la quimioterapia es disminuir la tasa de crecimiento (división celular) de las células cancerosas, los efectos secundarios se observan en sistemas corporales que naturalmente tienen un rápido recambio de células incluyendo piel, cabello, gastrointestinal y médula ósea. Estas células sanas y normales, también terminan dañadas por el programa de quimioterapia.
Categorías de Medicamentos de Quimioterapia
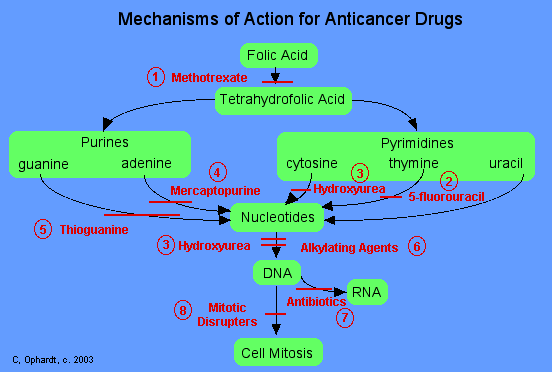
En general, los agentes quimioterapéuticos se pueden dividir en tres categorías principales en función de su mecanismo de acción como se muestra en la siguiente tabla.
| Categoría | Modo de acción específico | Ejemplos |
|---|---|---|
|
Detener la síntesis de bloques de construcción de moléculas pre ADN “Antimetabolitos” |
Estos agentes trabajan de diversas maneras. Los bloques de construcción de ADN son ácido fólico, bases heterocíclicas y nucleótidos, que se producen naturalmente dentro de las células. Todos estos agentes trabajan para bloquear algún paso en la formación de nucleótidos o desoxirribonucleótidos (necesarios para hacer ADN). Cuando se bloquean estos pasos, los nucleótidos, que sonlos bloques de construcción del ADN y el ARN, no se pueden sintetizar. Así las células no pueden replicarse porque no pueden producir ADN sin los nucleótidos. | 1) metotrexato (Abitrexate®) ,2) fluorouracilo (Adrucil®), 3) hidroxiurea (Hydrea®), 4) mercaptopurina (Purinethol®) y 5) tioguanina. |
|
Dañar directamente el ADN en el núcleo de la célula “Agentes alquilantes, antibióticos, inhibidores de topoisomerasa y agentes intercalantes”. |
Estos agentes dañan químicamente el ADN y el ARN. Interrumpen la replicación del ADN y o bien detienen totalmente la replicación o provocan la fabricación de ADN o ARN sin sentido (es decir, el nuevo ADN o ARN no codifica nada útil). | 5) cisplatino (Platinol®) y 7) antibióticos: daunorrubicina (Cerubidine®), doxorrubicina (Adriamycin®) y etopósido (VepeSid®). |
|
Efectuar la síntesis o descomposición de los husillos mitóticos “Disruptores mitóticos” |
Los husillos mitóticos sirven como ferrocarriles moleculares con “Polos Norte y Sur” en la celda cuando una célula comienza a dividirse en dos nuevas celdas. Estos husillos son muy importantes porque ayudan a dividir el ADN recién copiado de tal manera que una copia va a cada una de las dos nuevas células durante la división celular. Estos fármacos interrumpen la formación de estos husillos y por tanto interrumpen la división celular. | 8) Los disruptores mitóticos incluyen: Vinblastina (Velban®), Vincristina (Oncovin®) y Pacitaxel (Taxol®). |
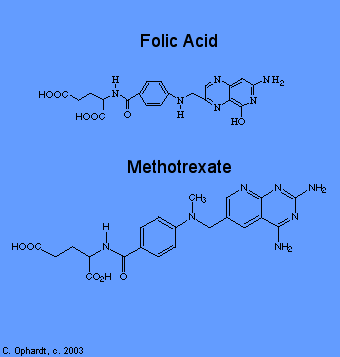
Metotrexato
El metotrexato inhibe la reductasa de ácido fólico que es responsable de la conversión del ácido fólico en ácido tetrahidrofólico. En dos etapas de la biosíntesis de purinas (adenina y guanina) y en una etapa en la síntesis de pirimidinas (timina, citosina y uracilo), ocurren reacciones de transferencia de un carbono que requieren coenzimas específicas sintetizadas en la célula a partir de ácido tetrahidrofólico.
El propio ácido tetrahidrofólico se sintetiza en la célula a partir del ácido fólico con la ayuda de una enzima, la reductasa de ácido fólico. El metotrexato se parece mucho al ácido fólico a la enzima, por lo que se une a él pensando que es ácido fólico. De hecho, el metotrexato se ve tan bien a la enzima que se une a ella con bastante fuerza e inhibe la enzima. Por lo tanto, la síntesis de ADN no puede continuar porque las coenzimas necesarias para las reacciones de transferencia de un carbono no se producen a partir del ácido tetrahidrofólico porque no hay ácido tetrahidrofólico. Nuevamente, sin ADN, sin división celular.
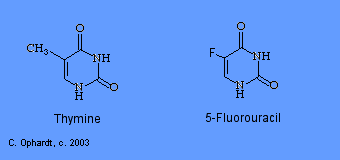
5-Fluorouracilo
5-Fluorouracilo (5-FU; Adrucil®, Fluorouracilo, Efudex®, Fluoroplex®) es un antimetabolito de pirimidina eficaz. El fluorouracilo se sintetiza en el nucleótido, 5-fluoro-2-desoxiuridina. Este producto actúa como antimetabolito al inhibir la síntesis de 2-desoxitimidina debido a que el enlace carbono-flúor es extremadamente estable y evita la adición de un grupo metilo en la posición 5. La falta de síntesis del nucleótido de timidina da como resultado poca o ninguna producción de ADN. Otros dos medicamentos similares incluyen: gemcitabina (Gemzar®) y arabinosilcitosina (AraC). Todos ellos trabajan a través de mecanismos similares.
Hidroxiurea
La hidroxiurea bloquea una enzima que convierte el nucleótido de citosina en el derivado desoxiado. Además, la síntesis de ADN se inhibe adicionalmente porque la hidroxiurea bloquea la incorporación del nucleótido de timidina en la cadena de ADN.
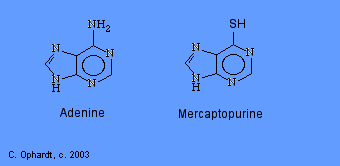
mercaptopurina
La mercaptopurina, un análogo químico de la purina adenina, inhibe la biosíntesis de nucleótidos de adenina actuando como antimetabolito. En el cuerpo, el 6-MP se convierte en el ribonucleótido correspondiente. El ribonucleótido 6-MP es un potente inhibidor de la conversión de un compuesto llamado ácido inosínico a adenina Sin adenina, el ADN no se puede sintetizar. El 6-MP también funciona al incorporarse a los ácidos nucleicos como tioguanosina, haciendo que el ácidos nucleicos resultantes (ADN, ARN) incapaces de dirigir la síntesis proteica adecuada.
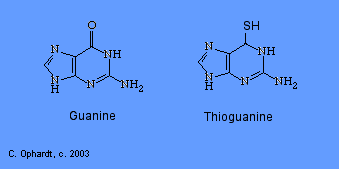
Tioguanina
La tioguanina es un antimetabolito en la síntesis de nucleótidos de guanina.
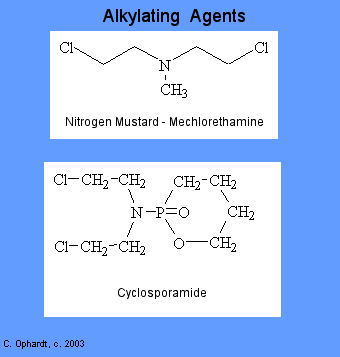
Agentes alquilantes
Los agentes alquilantes implican reacciones con guanina en el ADN. Estos fármacos agregan grupos metilo u otros grupos alquilo a las moléculas donde no pertenecen. Esto a su vez inhibe su correcta utilización mediante el emparejamiento de bases y provoca una codificación errónea del ADN.
Existen seis grupos de agentes alquilantes: mostazas nitrogenadas; etilenimas; alquilsulfonatos; triazenos; piperazinas; y nitrosureas. La ciclosporamida es un ejemplo clásico del papel del metabolismo del huésped en la activación de un agente alquilante y es uno o los agentes más utilizados de esta clase. Se esperaba que las células cancerosas pudieran poseer enzimas capaces de lograr la escisión, resultando así en la producción selectiva de una mostaza nitrogenada ada en las células malignas. Compara las estructuras superior e inferior en el gráfico de la izquierda.
Inhibidores de Topoisomerasa
Los inhibidores de la topoisomerasa son fármacos que afectan la actividad de dos enzimas: la topoisomerasa I y la topoisomerasa II. La inhibición de la topoisomerasa I o II interfiere tanto en la replicación como en la transcripción.
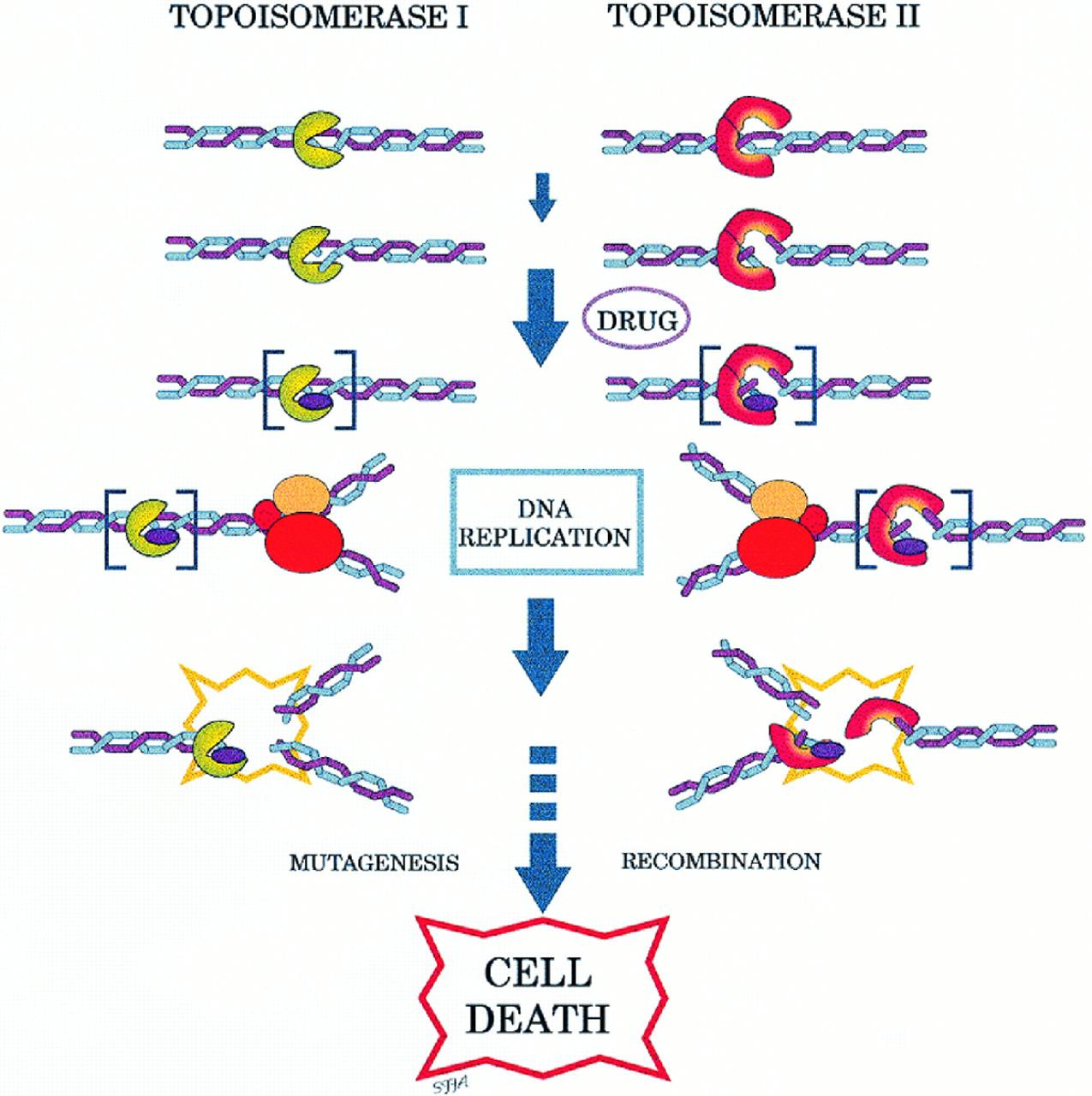
Dos inhibidores de la topoisomerasa I, el irinotecán y el topotecán, se derivan semisintéticamente de la camptotecina, la cual se obtiene del árbol ornamental chino Camptotheca acuminata. Los fármacos que se dirigen a la topoisomerasa II se pueden dividir en dos grupos. Los inhibidores de la topoisomerasa II incluyen etopósido, doxorrubicina, mitoxantrona, tenipósido, novobiocina, merbarona y aclarrubicina.
Antibióticos
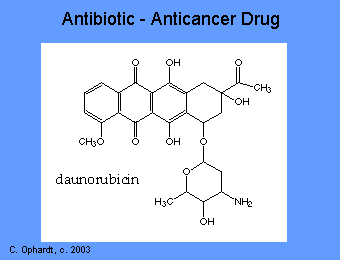
Varios antibióticos como antraciclinas, dactinomicina, bleomicina, adriamicina, mitramicina, se unen al ADN y lo inactivan. Así se evita la síntesis de ARN. Las propiedades generales de estos fármacos incluyen: interacción con el ADN en una variedad de formas diferentes incluyendo intercalación (compresión entre los pares de bases), rotura de la cadena de ADN e inhibición con la enzima topoisomerasa II. La mayoría de estos compuestos han sido aislados de fuentes naturales y antibióticos. Sin embargo, carecen de la especificidad de los antibióticos antimicrobianos y por lo tanto producen toxicidad significativa.
Las antraciclinas se encuentran entre los fármacos antitumorales más importantes disponibles. La doxorrubicina es ampliamente utilizada para el tratamiento de varios tumores sólidos, mientras que la daunorrubicina y la idarubicina se utilizan exclusivamente para el tratamiento de la leucemia. Estos agentes tienen una serie de efectos importantes que incluyen: intercalar (apretar entre los pares de bases) con ADN afectando muchas funciones del ADN incluyendo la síntesis de ADN y ARN. La rotura de la cadena de ADN también puede ocurrir por inhibición de la enzima topoisomerasa II.
Dactinomicina (Actinomicina D)
A bajas concentraciones, la dactinomicina inhibe la síntesis de ARN dirigida por ADN y a concentraciones más altas también se inhibe la síntesis de ADN. Todos los tipos de ARN están afectados, pero el ARN ribosómico es más sensible. La dactinomicina se une al ADN bicatenario, permitiendo el inicio de la cadena de ARN pero bloqueando la elongación La unión al ADN depende de la presencia de guanina.
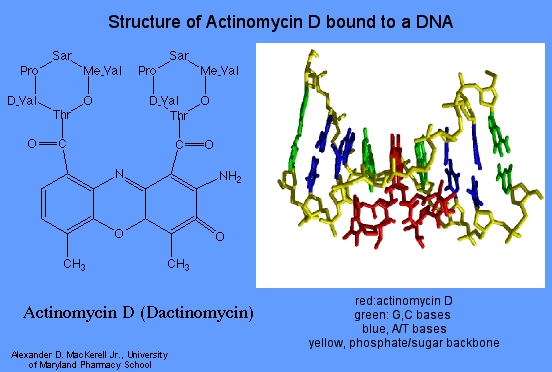
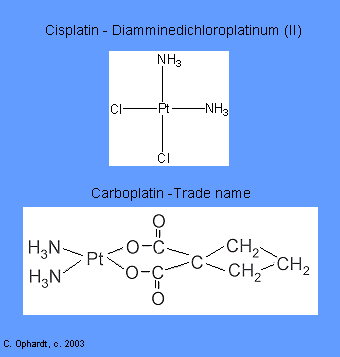
Agentes Intercalantes
Los agentes intercalantes se encuentran entre las bases a lo largo del ADN. Las moléculas de fármaco intercaladas afectan la estructura del ADN, impidiendo que la polimerasa y otras proteínas de unión al ADN funcionen correctamente. El resultado es la prevención de la síntesis de ADN, la inhibición de la transcripción y la inducción de mutaciones. Los ejemplos incluyen: Carboplatino y Cisplatino.
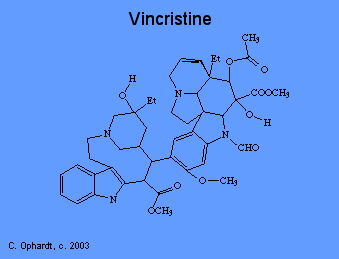
Disruptores mitóticos
Los alcaloides vegetales como la vincristina previenen la división celular o la mitosis. Existen varias fases de la mitosis, una de las cuales es la metafase. Durante la metafase, la célula tira de cromosomas de ADN duplicados a ambos lados de la célula parental en estructuras llamadas “husillos”. Estos husillos aseguran que cada nueva célula obtenga un conjunto completo de ADN. Los husillos son fibras microtubulares formadas con la ayuda de la proteína “tubulina”. La vincristina se une a la tubulina, evitando así la formación de husillos y división celular.
Taxol
El paclitaxel (taxol) se aisló primero de la corteza del tejo del Pacífico (Taxus brevifolia). Docetaxel es un análogo más potente que se produce semisintéticamente. A diferencia de otros antagonistas de microtúbulos, el taxol altera el equilibrio entre la tubulina libre y los mircrotúbulos desplazándola en la dirección del ensamblaje, en lugar del desmontaje. Como resultado, el tratamiento con taxol provoca tanto la estabilización de los microtúbulos como la formación de haces anormales de microtúbulos. El efecto neto sigue siendo la alteración de la mitosis.
Quimioterapia combinada
En 1965, se produjo un gran avance en la terapia contra el cáncer. James F. Holland, Emil Freireich y Emil Frei plantearon la hipótesis de que la quimioterapia contra el cáncer debe seguir la estrategia de la terapia antibiótica para la tuberculosis con combinaciones de fármacos, cada uno con un mecanismo de acción diferente. Las células cancerosas podrían posiblemente mutar para volverse resistentes a un solo agente, pero al usar diferentes fármacos simultáneamente sería más difícil para el tumor desarrollar resistencia a la combinación. Holland, Freireich y Frei administraron simultáneamente metotrexato (un antifolato), vincristina (alcaloide de Vinca), 6-mercaptopurina (6-MP) y prednisona —denominados conjuntamente el régimen POMP— e indujeron remisiones a largo plazo en niños con leucemia linfoblástica aguda (LLA). Con refinamientos incrementales de los regímenes originales, utilizando estudios clínicos aleatorizados del St. Jude Children's Research Hospital, el Medical Research Council en el Reino Unido (protocolos UKALL) y el grupo de ensayos clínicos alemanes Berlin-Frankfurt-Münster (protocolos ALL-BFM), la ALL en niños se ha convertido en un enfermedad.
Este abordaje fue extendido a los linfomas en 1963 por Vincent T. DeVita y George Canellos en el NCI, quienes finalmente demostraron a fines de la década de 1960 que la mostaza nitrogenada, vincristina, procarbazina y prednisona —conocida como el régimen MOPP— podían curar pacientes con linfoma de Hodgkin y no Hodgkin.
Actualmente, casi todos los regímenes exitosos de quimioterapia contra el cáncer utilizan este paradigma de múltiples fármacos administrados simultáneamente, llamados quimioterapia combinada o poliquimioterapia.
| Tipo de cáncer | Drogas | Acrónimos |
|---|---|---|
| Cáncer de mama | Ciclofosfamida, metotrexato, 5-fluorouracilo, vinorelbina | CMF |
| Doxorubicina, ciclofosfamida | AC | |
| Linfoma de Hodgkin | Docetaxel, doxorrubicina, ciclofosfamida | TAC |
| Doxorubicina, bleomicina, vinblastina, dacarazina | ABVD | |
| Mustina, vincristina, procarbazina, prednisolona | MOPP | |
| Linfoma no Hodgkin | Ciclofosfamida, doxorrubicina, vincristina, prednisolona | PICAR |
| Tumor de células germinales | Bleomicina, etopósido, cisplatino | BEP |
| Cáncer de estómago | Epirrubicina, cisplatino, 5-fluorouracilo | ECF |
| Epirrubicina, cisplatino, capecitabina | ECX | |
| Cáncer de vejiga | Metotrexato, vincristina, doxorrubicina, cisplatino | MVAC |
| Cáncer de pulmón | Ciclofosfamida, doxorrubicina, vincristina, vinorelbina | CAV |
| Cáncer colorrectal | 5-fluorouracilo, ácido folínico, oxaliplatino | FOLFOX |
Resumen
- La quimioterapia es un tipo de tratamiento contra el cáncer que usa uno o más medicamentos anticancerosos (agentes quimioterapéuticos) como parte de un régimen de quimioterapia estandarizado.
- Los quimiofármacos pueden clasificarse en tres categorías principales en función de su mecanismo de acción, a saber:
- Detener la síntesis de bloques de construcción de moléculas pre-ADN
- Dañar directamente el ADN en el núcleo de la célula
- Efectuar la síntesis o descomposición de los husillos mitóticos.
- Actualmente, casi todos los regímenes exitosos de quimioterapia contra el cáncer utilizan este paradigma de múltiples fármacos administrados simultáneamente, llamados quimioterapia combinada o poliquimioterapia.
Colaboradores
- Wikipedia
- Charles Ophardt, Professor Emeritus, Elmhurst College; Virtual Chembook