21.1: Limpieza con Jabón
- Page ID
- 71938
- Describir el mecanismo por el cual los jabones ejercen su acción limpiadora.
- Enumere los beneficios y problemas con el uso de jabón.
Limpieza Personal
El jabón es una sal de un ácido graso [1] utilizado en una variedad de productos limpiadores y lubricantes. En un ambiente doméstico, los jabones son tensioactivos que generalmente se usan para lavar, bañarse y otros tipos de limpieza. En entornos industriales, los jabones se utilizan como espesantes, componentes de algunos lubricantes y precursores de catalizadores.
Cuando se usa para la limpieza, el jabón solubiliza partículas y mugre, que luego se pueden separar del artículo que se está limpiando. En el lavado de manos, como surfactante, cuando se enjabona con un poco de agua, el jabón mata microorganismos desorganizando su bicapa lipídica de membrana y desnaturalizando sus proteínas. También emulsiona los aceites, permitiendo que sean arrastrados por el agua corriente. [2]
Los jabones de barra fabricados industrialmente estuvieron disponibles a finales del siglo XVIII, ya que las campañas publicitarias en Europa y América promovieron la conciencia popular sobre la relación entre limpieza y salud. [35] En los tiempos modernos, el uso del jabón se ha convertido en algo común en las naciones industrializadas debido a una mejor comprensión del papel de la higiene en la reducción del tamaño poblacional de microorganismos patógenos (Figura\(\PageIndex{1}\)).

Fabricación de jabón: La grasa más lejía forma un jabón más glicerol
La evidencia más temprana registrada de la producción de materiales similares al jabón se remonta a alrededor del 2800 aC en la antigua Babilonia. [10] Una fórmula para jabón que consiste en agua, álcali y aceite de casia se escribió en una tableta de arcilla babilónica alrededor del 2200 a.C. [11]
El papiro de Eber (Egipto, 1550 a.C.) indica que los antiguos egipcios se bañaban regularmente y combinaban aceites animales y vegetales con sales alcalinas para crear una sustancia similar al jabón. Los documentos egipcios mencionan que se utilizó una sustancia similar en la preparación de lana para tejer. [12] En el reinado de Nabónido (556—539 a.C.), una receta de jabón consistía en uhulu [cenizas], ciprés [aceite] y sésamo [aceite de semilla] “para lavar las piedras para las sirvientas”. [13] En el antiguo Israel, las cenizas de plantas de barilla, como especies de Salsola, saltwort (Seidlitzia rosmarinus) y Anabasis, se utilizaron en la producción de jabón, conocida como potasa

Hasta la Revolución Industrial, la elaboración del jabón se realizaba a pequeña escala y el producto era áspero. En 1780, James Keir estableció una obra química en Tipton, para la fabricación de álcalis a partir de los sulfatos de potasa y soda, a los que posteriormente añadió una fábrica de jabón. William Gossage produjo jabón de bajo precio y buena calidad a partir de la década de 1850. Robert Spear Hudson comenzó a fabricar un jabón en polvo en 1837, inicialmente moliendo el jabón con un mortero y una mano de mortero. El fabricante estadounidense Benjamin T. Babbitt introdujo innovaciones de marketing que incluyeron la venta de jabón en barra y la distribución de muestras de productos. William Hesketh Lever y su hermano, James, compraron una pequeña fábrica de jabón en Warrington en 1886 y fundaron lo que sigue siendo uno de los mayores negocios de jabón, antes llamado Lever Brothers y ahora llamado Unilever. Estos negocios de telenovelas fueron de los primeros en emplear campañas publicitarias a gran escala. Un cartel publicitario se muestra en la Figura\(\PageIndex{2}\).
El jabón líquido no se inventó hasta el siglo XIX; en 1865, William Shepphard patentó una versión líquida del jabón. [40] En 1898, B.J. Johnson desarrolló un jabón derivado de aceites de palma y oliva; su compañía, la empresa B.J. Johnson Soap Company, introdujo el jabón de la marca “Palmolive” ese mismo año. [41] Esta nueva marca de jabón se popularizó rápidamente, y hasta tal punto que B.J. Johnson Soap Company cambió su nombre a Palmolive. [42]
Las grasas y aceites pueden participar en una variedad de reacciones químicas, por ejemplo, debido a que los triglicéridos son ésteres, pueden hidrolizarse en presencia de un ácido, una base o enzimas específicas conocidas como lipasas. La hidrólisis de grasas y aceites en presencia de una base se utiliza para elaborar jabón y se llama saponificación. Hoy en día la mayoría de los jabones se preparan a través de la hidrólisis de triglicéridos (a menudo a partir de sebo, aceite de coco, o ambos) usando agua a alta presión y temperatura [700 lb/in 2 (~50 atm o 5,000 kPa) y 200°C]. Luego se usa carbonato de sodio o hidróxido de sodio para convertir los ácidos grasos en sus sales de sodio (moléculas de jabón):
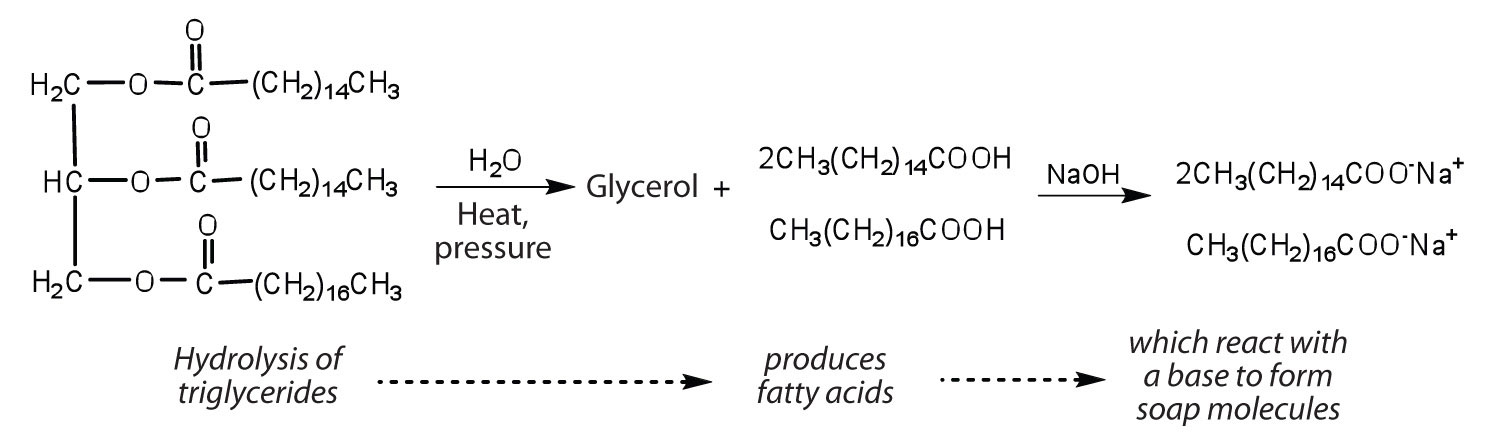
Figura \(\PageIndex{3}\)Saponificación.
Cómo funciona el jabón
La acción limpiadora del jabón está determinada por sus estructuras polares y no polares en conjunción con una aplicación de principios de solubilidad. La cadena larga de hidrocarburos es, por supuesto, no polar e hidrofóbica (repelida por el agua). El extremo “sal” de la molécula de jabón es iónico e hidrófilo (soluble en agua). Ejemplos de moléculas de jabón y detergente, se muestran en la Figura\(\PageIndex{4}\). El uso de tales compuestos como agentes limpiadores se ve facilitado por su carácter tensioactivo, que disminuye la tensión superficial del agua, permitiendo que penetre y humedezca una variedad de materiales.
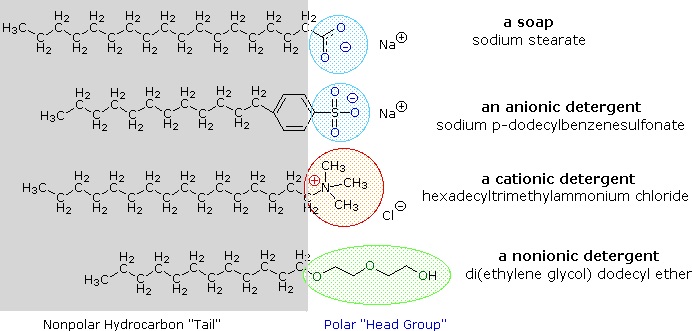
Cuando se agrega jabón al agua, el extremo de sal iónica de la molécula se atrae al agua y se disuelve en ella. El extremo hidrocarbonado no polar de la molécula de jabón es repelido por el agua. Una o dos gotas de jabón en agua forman una monocapa (Figura\(\PageIndex{5}\)) en la superficie del agua como se muestra en los gráficos de la izquierda. Las moléculas de jabón “se levantan” en la superficie a medida que el extremo de la sal de carboxilo polar es atraído por el agua polar. Las colas de hidrocarburos no polares son repelidas por el agua, lo que las hace parecer ponerse de pie.

Jabón vs. aceite vs agua
El agua por sí sola no es capaz de penetrar la grasa o el aceite porque son de polaridad opuesta. Cuando la grasa o el aceite (hidrocarburos no polares) se mezclan con una solución de agua jabonosa, las moléculas de jabón funcionan como un “puente” entre las moléculas de agua polar y las moléculas de aceite no polares. Las moléculas de jabón tienen propiedades no polares y polares en los extremos opuestos de la molécula.
El aceite es un hidrocarburo puro por lo que es no polar. La cola de hidrocarburo no polar del jabón se disuelve en el aceite. Eso deja el ion carboxilato polar de las moléculas de jabón que sobresalen de las gotitas de aceite, la superficie de cada gotita de aceite está cargada negativamente. Como resultado, las gotas de aceite se repelen entre sí y permanecen suspendidas en solución (esto se llama emulsión) para ser arrastradas por una corriente de agua. El exterior de la gotita también está recubierto con una capa de moléculas de agua.
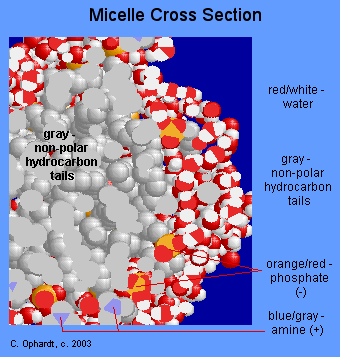
El gráfico en Figura\(\PageIndex{6}\) aunque no estrictamente una representación de la descripción anterior es una micela que funciona de la misma manera. El aceite sería un el centro de la micela.
Desventajas y ventajas del jabón
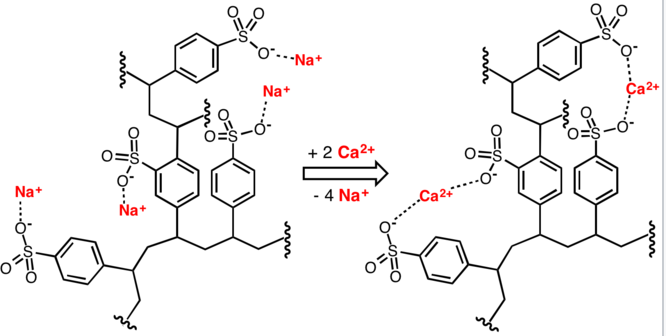
La importancia del jabón para la civilización humana está documentada por la historia, pero se han reconocido algunos problemas asociados a su uso. Uno de ellos es causado por la acidez débil (pKa ca. 4.9) de los ácidos grasos. Las soluciones de jabones de metales alcalinos son ligeramente alcalinas (pH 8 a 9) debido a la hidrólisis. Si el pH de una solución de jabón es bajado por contaminantes ácidos, los ácidos grasos insolubles precipitan y forman una escoria. Un segundo problema es causado por la presencia de sales de calcio y magnesio en el suministro de agua (agua dura). Estos cationes divalentes provocan la agregación de las micelas, que luego se depositan como una escoria sucia.
En la reacción a continuación, el catión de sodio en el jabón es reemplazado por calcio para formar estearato de calcio. El precipitado blanco, también denominado escoria de jabón, podría formar depósitos en las superficies y en el interior de las tuberías.
2 C 17 H 35 COO − Na + + Ca 2+ → (C 17 H 35 COO) 2 Ca + 2 Na +
El jabón sigue siendo un producto muy popular ya que es un producto de bajo costo y fácilmente disponible que se usa para la higiene personal y la limpieza. El uso de jabón no conduce a la contaminación. El jabón es biodegradable ya que puede ser descompuesto por microorganismos que se encuentran en las aguas residuales.
Video \(\PageIndex{1}\)Jabón y coronavirus.
Ablandadores de Agua
El ablandamiento del agua es la eliminación de calcio, magnesio y ciertos otros cationes metálicos en el agua dura. El agua blanda resultante requiere menos jabón para el mismo esfuerzo de limpieza, ya que el jabón no se desperdicia uniéndose con iones de calcio. El agua blanda también extiende la vida útil de la plomería al reducir o eliminar la acumulación de incrustaciones en tuberías y accesorios. El ablandamiento del agua generalmente se logra utilizando resinas suavizantes de cal o de intercambio iónico (ver Figura\(\PageIndex{7}\)), pero cada vez se está logrando utilizando membranas de nanofiltración u ósmosis inversa.
Cómo ablandar el agua dura
Algunos desean ablandar el agua dura para controlar sus efectos irritantes, y en muchos casos dañinos. La disminución de la capacidad del jabón para hacer espuma no solo es molesta, sino que también puede ser potencialmente dañina económicamente. Los negocios que dependen de la formación de espuma del jabón, como los lavados de autos y los peluqueros de mascotas, tal vez deseen ablandar el agua dura para evitar el uso excesivo de jabón debido a una menor capacidad de espumar. Asimismo, a menudo es necesario ablandar el agua que entra en contacto con las tuberías para evitar la acumulación destructiva y comprometedora de depósitos. Además, muchas personas pueden encontrar desfavorables los efectos calcificantes que el agua dura tiene en los grifos y otros artículos y optar por ablandar el agua para evitar que se formen dichos depósitos minerales. A otros les puede disgustar la sensación pegajosa y seca que deja la precipitación de espuma de jabón sobre la piel. Cualesquiera que sean las razones, hay muchos procesos disponibles para ablandar el agua dura.
Intercambio iónico
Una forma de ablandar el agua es a través de un proceso llamado intercambio iónico. Durante el intercambio iónico, los iones no deseados se “intercambian” por iones más aceptables. En muchos casos, es deseable sustituir los iones de agua dura, como Ca 2 + y Mg 2 +, por iones más agradables, como el de Na +. Para ello, el agua dura se conduce a través de una zeolita o columna que contiene resina, la cual une los iones no deseados a su superficie y libera los iones más tolerables. En este proceso, los iones de agua dura se convierten en iones “fijos” debido a su unión al material de resina. Estos iones fijos desplazan los iones deseables (Na +), ahora denominados contraiones, de la columna, intercambiando así los iones en el agua. Este proceso se ilustra en la Figura\(\PageIndex{8}\).
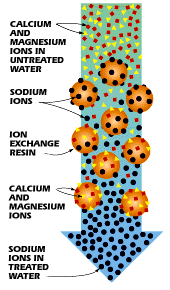
Desafortunadamente, este proceso tiene la desventaja de aumentar el contenido de sodio del agua potable, lo que podría ser potencialmente peligroso para la salud de las personas con dietas restringidas en sodio.
Suavizante de cal
Otro proceso se llama ablandamiento de cal. En este proceso, el compuesto hidróxido de calcio, Ca (OH) 2, se agrega al agua dura. El hidróxido de calcio, o “cal apagada”, eleva el pH del agua y hace que el calcio y el magnesio precipiten en CaCo 3 y Mg (OH) 2. Estos precipitados pueden filtrarse fácilmente debido a su insolubilidad en agua, que se muestra a continuación por la pequeña constante de solubilidad del hidróxido de magnesio (la constante del producto de solubilidad para el carbonato de calcio se muestra arriba). Después de la precipitación y eliminación de los iones ofensivos, se agrega ácido para que el pH del agua vuelva a la normalidad.
\[Mg(OH)_{2 \; (s)} \rightleftharpoons Mg^{2+}_{(aq)} + 2OH^-_{(aq)} \tag{4a} \]
Quelación
También se pueden usar agentes quelantes para ablandar el agua dura. Los ligandos polidentados, como el popular ligando hexadentado EDTA, se unen a los iones indeseables en agua dura. Estos ligandos son especialmente útiles en la unión de los cationes magnesio y calcio, que como ya se mencionó son altamente prevalentes en soluciones de agua dura. El agente quelante forma un complejo anular muy estable con los cationes metálicos, lo que impide que interactúen con cualquier otra sustancia que pueda introducirse en la solución, como el jabón. De esta manera, los quelantes son capaces de disminuir los efectos negativos asociados al agua dura. A continuación se muestra una ecuación simplificada que representa la quelación del catión metálico de calcio (Ca 2 +) con el ligando hexadentado EDTA. El gran valor de la constante de formación (K f) refleja la tendencia de la reacción a proceder a su finalización en la dirección hacia adelante.
\[Ca^{2+} + EDTA^{4-} \longrightarrow [Ca(EDTA)]^{2-} \tag{5a} \]
Ósmosis Inversa
El proceso final, ósmosis inversa, utiliza altas presiones para forzar al agua a través de una membrana semipermeable. Esta membrana generalmente está destinada a ser impermeable a cualquier cosa que no sea agua. La membrana sirve para filtrar los iones más grandes y moléculas responsables de la dureza del agua, resultando en agua ablandada. Durante este proceso, el agua es forzada desde un área con una alta concentración de soluto en forma de iones metálicos disueltos y compuestos similares, a un área que es muy baja en la concentración de estas sustancias. En otras palabras, el agua pasa de un estado de dureza a una composición más blanda ya que se impide el paso de los iones que causan la dureza del agua a través de la membrana. La ósmosis inversa tiene la desventaja de desperdiciar aguas residuales en comparación con otros métodos de tratamiento de agua. Este proceso se muestra en la Figura\(\PageIndex{9}\) a continuación. Obsérvese que esta cifra describe la desalinización del agua salada. Sin embargo, el proceso para ablandar el agua dura es el mismo.
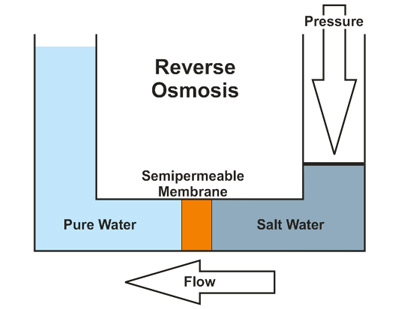
Hacer que el agua dura sea blanda
Video \(\PageIndex{2}\)Cómo ablandar el agua dura.
Resumen
- El jabón, como agente de limpieza, solubiliza las partículas y la mugre, que luego se pueden eliminar fácilmente del artículo que se está limpiando.
- En el lavado de manos, el jabón es un excelente surfactante, que destruye microorganismos al dañar sus membranas celulares y desnaturalizar sus proteínas.
- El jabón es un agente de limpieza económico y fácilmente disponible que también es efectivo y es biodegradable disminuido. Sin embargo, su efectividad disminuye cuando se usa con agua dura.
Colaboradores
- Wikipedia
- Libretext: Organic Chemistry (McMurry)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- Charles Ophardt, Professor Emeritus, Elmhurst College; Virtual Chembook
- Andrea Kubisch, Courtney Korff (UCD)

