16.10: Métodos Preparativos para Aldehídos y Cetonas
- Page ID
- 73563
En capítulos anteriores se han considerado diversas reacciones útiles para la preparación de aldehídos y cetonas, como la ozonización de alquenos y la hidratación de alquinos. Estos y otros métodos de preparación se resumen en los Cuadros 16-7 y 16-8 al final del capítulo. Aquí sólo se abordarán algunos métodos bastante generales que no hemos discutido.
Oxidación de 1,2-Dioles y Alquenos
Los aldehídos y cetonas a menudo se pueden preparar por oxidación de alquenos a 1,2-dioles (Secciones 11-7C y 11-7D), seguido de la escisión oxidativa de los 1,2-dioles con tetraetanoato de plomo o peryato de sodio. Por ejemplo,
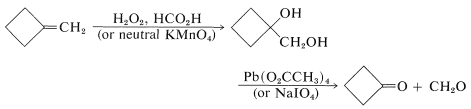
La escisión de los glicoles con estos reactivos procede de acuerdo con la siguiente estequiometría:
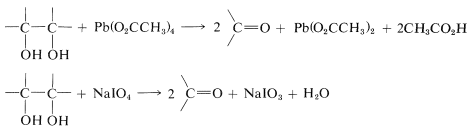
Oxidación de alcoholes primarios y compuestos relacionados
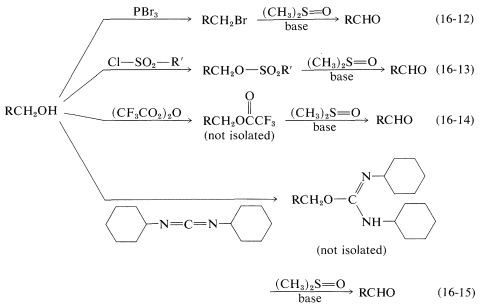
En el Capítulo 15 se demostró que los alcoholes primarios\(\ce{RCH_2OH}\),, se oxidan fácilmente a aldehídos\(\ce{RCHO}\),, y alcoholes secundarios\(\ce{R_2CHOH}\),, a cetonas\(\ce{R_2CO}\),, por reactivos inorgánicos como\(\ce{CrO_3}\) y\(\ce{KMnO_4}\). Sin embargo, es un problema evitar la sobreoxidación con alcoholes primarios debido a la facilidad con la que los aldehídos se oxidan a ácidos,\(\ce{RCHO} \rightarrow \ce{RCO_2H}\). Un oxidante más suave es metilsulfinilmetano [dimetilsulfóxido\(\ce{(CH_3)_2S=O}\)], y este reactivo puede usarse para preparar aldehídos a partir de alcoholes por medio de un intermedio tal como el éster o haluro en el que el\(\ce{OH}\) grupo se convierte en un mejor grupo lábil:
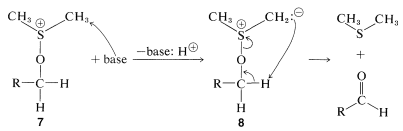
Cualquiera que sea el método empleado, la etapa clave es la formación de una sal alcoxisulfonio\(7\), mediante una reacción de desplazamiento que involucra dimetilsulfóxido como nucleófilo de oxígeno. (Observe que el\(\ce{S=O}\) enlace, al igual que los\(\ce{C=O}\) enlaces, está fuertemente polarizado como\(\overset{\oplus}{\ce{S}} \ce{-} \overset{\ominus}{\ce{O}}\).)
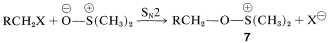
En los ejemplos enumerados en las Ecuaciones 16-12 a 16-15, el\(\ce{X}\) grupo es\(\ce{Br}\),\(\ce{-OSO_2R'}\),\(\ce{-O_2CCF_3}\), y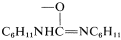 , respectivamente. En la etapa nido se forma un iluro de azufre\(8\),, a partir de la reacción de una base con\(7\), pero el iluro evidentemente es inestable y se fragmenta por una\(E2\) reacción interna para formar un aldehído:
, respectivamente. En la etapa nido se forma un iluro de azufre\(8\),, a partir de la reacción de una base con\(7\), pero el iluro evidentemente es inestable y se fragmenta por una\(E2\) reacción interna para formar un aldehído:
Reducción de Ácidos Carboxílicos a Aldehídos
La conversión de un ácido carboxílico en aldehído por reducción directa no es fácil de lograr, porque los ácidos generalmente son difíciles de reducir, mientras que los aldehídos se reducen fácilmente. Así el problema es evitar que la reacción vaya demasiado lejos.
Los procedimientos más útiles implican la conversión del ácido en un derivado que o bien se reduce más fácilmente que un aldehído, o bien se reduce a una sustancia a partir de la cual se puede generar el aldehído. La llamada reducción de Rosenmund implica el primero de estos esquemas; en este procedimiento, el ácido se convierte en un cloruro de acilo, que se reduce con hidrógeno sobre un catalizador de paladio al aldehído en rendimientos de hasta\(90\%\). La tasa de reducción del aldehído al alcohol correspondiente se mantiene en un nivel bajo envenenando el catalizador con suflur:
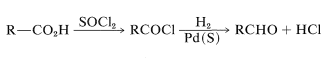
Los hidruros metálicos, como el hidruro de litio y aluminio, también se pueden usar para reducir derivados de ácidos carboxílicos (como amidos y nitrilos ver Cuadro 16-6) a aldehídos. A continuación se muestra un ejemplo:
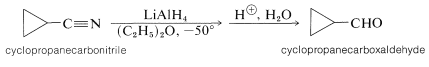
Reordenamientos de 1,2-dioles
Muchos compuestos de carbonilo se pueden sintetizar mediante reordenamientos catalizados por ácido de 1,2-dioles (un tipo de reacción a menudo llamado reordenamiento de “pinacol-pinacolona”).
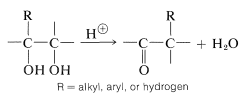
Las características generales de la reacción son similares a las de los reordenamientos de carbocationes (Sección 8-9B). El ácido ayuda a la reacción protonando uno de los\(\ce{-OH}\) grupos para convertirlo en un mejor grupo de salida. El carbocatión que resulta entonces puede sufrir un reordenamiento por desplazamiento del\(\ce{R}\) grupo vecino con su par de electriones de unión para dar una nueva especie termodinámicamente más estable con un doble enlace carbono-oxígeno (ver Sección 16-7).
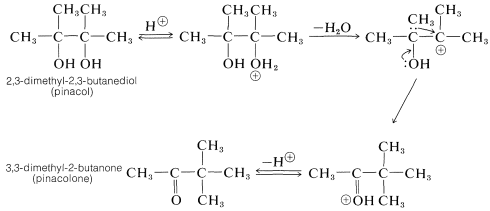
El prototipo de este reordenamiento es la conversión de pinacol a pinacolona de la siguiente manera:
Reordenamientos de Hidroperóxidos
Un método importante para preparar compuestos de carbonilo (e hidroxi), especialmente a escala industrial, es a través de reordenamientos de hidroperóxidos de alquilo:
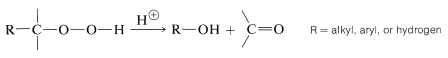
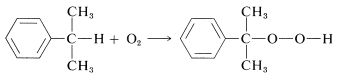
Los peróxidos se pueden hacer en algunos casos por oxidación directa al aire de hidrocarburos,
y en otros por adición inducida por ácido sulfúrico de peróxido de hidrógeno (as\(\ce{H-O_2H}\)) a dobles enlaces:
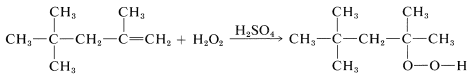
(Observe que el peróxido de hidrógeno en el ácido metanoico se comporta de manera diferente hacia los alquenos al producir adición de\(\ce{HO-OH}\), Sección 11-7D.) La oxidación directa al aire de los hidrocarburos es mecanísticamente similar a la del bencenocarbaldehído (Sección 16-7).
Los reordenamientos de los hidroperóxidos son catalizados por ácido y son análogos a los reordenamientos de carbocationes, excepto que el oxígeno positivo (con solo seis electrones de valencia) en lugar de carbono positivo está involucrado en la etapa intermedia:
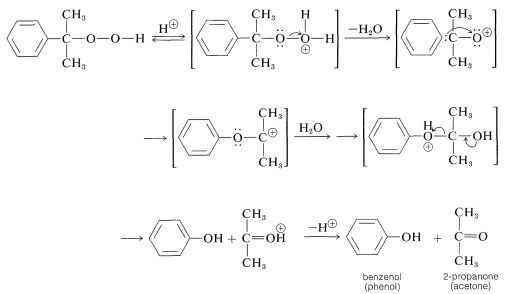
En principio, ya sea fenilo o metilo podrían migrar al oxígeno positivo, pero en este caso solo ocurre la migración de fenilo. La reacción de reordenamiento está estrechamente relacionada con la reacción de Baeyer-Villiger (Sección 16-7).
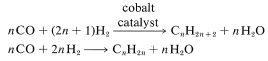
Aldehídos por Hidroformilación de Alquenos
Esta reacción es importante por varias razones. Es una síntesis industrial de aldehídos a partir de alquenos mediante la adición de monóxido de carbono e hidrógeno en presencia de un catalizador de cobalto. Un excelente ejemplo es la síntesis de butanal a partir de propeno, en la que también se forma 2-metilpropanal:
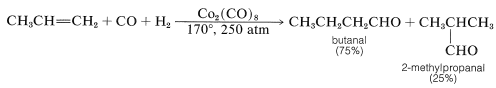
Como puede ver, la reacción equivale formalmente a la adición de metanal como\(\ce{H-CHO}\) al doble enlace alqueno. Debido a que un átomo de carbono adicional se introduce como\(\ce{CHO}\) grupo “formilo”, la reacción a menudo se llama hidroformilación, aunque el nombre más antiguo, reacción oxo, es ampliamente utilizado.
La hidroformilación para producir aldehídos es el primer paso en una importante ruta industrial hacia los alcoholes. Los aldehídos intermedios se reducen a alcoholes por hidrogenación catalítica. Grandes cantidades de\(\ce{C_4}\) -\(\ce{C_8}\) alcoholes se preparan por esta secuencia:
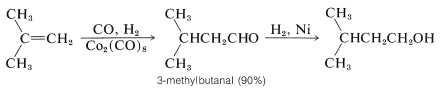
También es digna de mención la historia de la reacción oxo. Fue desarrollado originalmente en Alemania en los años posteriores a la Primera Guerra Mundial En ese momento, la industria química alemana se enfrentaba a suministros inadecuados de petróleo. Por lo tanto, muchos químicos alemanes recurrieron a la investigación sobre formas por las cuales los hidrocarburos podrían sintetizarse a partir de bloques de construcción más pequeños, particularmente monóxido de carbono e hidrógeno derivado del carbón. El éxito logrado fue notable y condujo a síntesis de alcanos y alquenos conocidos como el proceso Fischer-Tropsch:
Esta reacción a su vez condujo al descubrimiento de que los aldehídos se formaron por la adición adicional de monóxido de carbono e hidrógeno a los alquenos, y se desarrolló aún más como el proceso oxo para la producción de alcoholes. La combinación\(\ce{CO} + \ce{H_2}\) a menudo se llama “gas sintético”. Se prepara mediante la reducción de agua a presión y a temperaturas elevadas por carbono (generalmente coque), metano o hidrocarburos de mayor peso molecular:
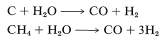
Carbonilación de alquilboranos
La síntesis de aldehídos por hidroformilación de alquenos descrita en la sección anterior se puede lograr indirectamente utilizando hidruros de boro. Una expresión sobresimplificada de esta reacción es
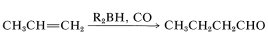
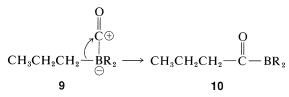
La reacción global es bastante compleja pero implica un reordenamiento similar al descrito para la hidroboración-oxidación de alquenos (Sección 11-6E). El primer paso es la hidroboración del alqueno a un trialquilborano. Cuando el trialquilborano se expone al monóxido de carbono, reacciona (carbonilatos) para formar un boro tetracovalente,\(9\):
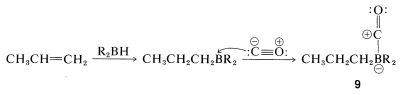
El complejo\(9\) es inestable y se reorganiza por transferencia de un grupo alquilo del boro al carbono carbonilo deficiente en electrones para dar\(10\):
Ahora, si un agente reductor de hidruro metálico, tal como\(\ce{LiAlH_4}\), está presente, el grupo carbonilo de\(10\) se reduce y\(11\) se forma:
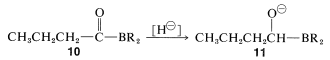
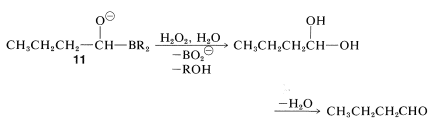
El producto de reducción,\(11\), se puede convertir en un aldehído por oxidación con peróxido de hidrógeno acuoso, siempre que se controle cuidadosamente el pH. (Recuerde, los aldehídos son inestables en base fuerte).
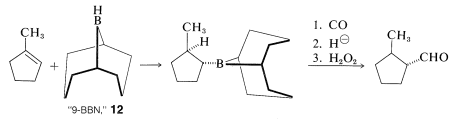
Es posible que hayas notado que solo uno de los tres grupos alquilo de un trialquilborano se convierte en aldehído por la secuencia de carbonilación-reducción-oxidación. Para asegurar que la carbonilación tome el curso deseado sin desperdiciar el alqueno de partida, la hidroboración se logra convenientemente con un borano impedido, tal como “9-BBN”,\(12\). Con\(12\), solo el grupo alquilo menos impedido se reorganiza en la etapa de carbonilación:
La carbonilación de alquilboranos también puede producir cetonas. Las condiciones son similares a las de la síntesis de aldehídos excepto que se omite el agente reductor de hidruro. Al omitir el agente reductor, puede ocurrir un segundo reordenamiento de boro a carbono. La oxidación produce entonces una cetona:
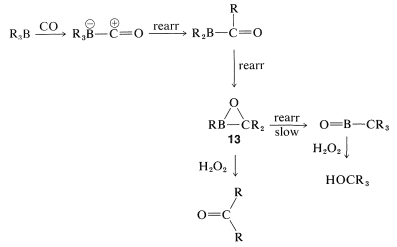
El reordenamiento continuará por tercera vez (en última instancia, para producir un alcohol terciario) a menos que el movimiento del grupo alquilo que permanece en el boro\(13\) se evite por impedimento estérico.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


