2.1: Polimerización Ziegler-Natta
- Page ID
- 71958
Hay alquenos que no dan lugar a cationes lo suficientemente estables para la polimerización catiónica, y tampoco forman aniones lo suficientemente estables para la polimerización aniónica. Los dos ejemplos más destacados son el eteno y el propeno. Sin embargo, el eteno y el propeno son las materias primas más comunes para polímeros, con alrededor de 100 millones de toneladas de producción mundial de polietileno anualmente y alrededor de 50 millones de polipropileno. Entonces, ¿cómo hacemos cantidades tan grandes de polietileno y polipropileno?
Estos monómeros se polimerizan a través de un ciclo organometálico de asociaciones de alquenos y 1,2-inserciones, de manera que el último alqueno se convierte en parte de un grupo alquilo metálico listo para someterse a inserción con el siguiente alqueno que se une al metal. Este proceso fue desarrollado en 1952 por Karl Ziegler en el Instituto Max Planck para la Investigación del Carbón en Mulheim, Alemania. El método fue posteriormente mejorado por Giulio Natta en el Politécnico de Milán.
Las condiciones industriales de uso común para la polimerización Ziegler-Natta emplean un sistema multicomponente. Siempre hay un catalizador de metal de transición temprano, desde el lado izquierdo del bloque d de la tabla periódica. Típicamente, este catalizador es TiCl 4 o TiCl 3; en las condiciones de reacción, el TiCl 4 probablemente se reduce a TiCl 3 de todos modos. Este catalizador está soportado sobre otros haluros metálicos como MgCl 2. En catálisis heterogénea, un soporte es una capa que interactúa fuertemente con el catalizador, ajustando sus propiedades; exactamente cómo funciona es algo complicado. El catalizador y el soporte se depositan sobre un soporte sólido, como sílice, SiO 2, que distribuye el catalizador, aumentando el área de superficie utilizable. Además, el portador puede modificar el espacio tridimensional alrededor del catalizador, proporcionando un bolsillo de unión para el catalizador y el sustrato, por ejemplo. Por último, el sistema necesita un activador, que es un alquilo metálico del bloque p como el trietilaluminio. Este compuesto transfiere un grupo alquilo de partida al catalizador y también puede reducir las especies de metales de transición.
Un catalizador de Ti (III) en lugar de Ti (IV) tiene la ventaja de poder unir mejor el sustrato alqueno. Ti (IV) es una especie d 0, y los metales d 0 son típicamente incapaces de unirse a alquenos. La donación relativamente débil de enlace π a un metal normalmente se incrementa por la donación posterior de un metal ocupado d orbital al alqueno π* orbital.
Ejercicio 2.1.1
Echemos un vistazo a algunos reactivos alternativos de Ziegler-Natta. Identificar cada componente como un posible catalizador, soporte, portador o activador.
- ZrCl 4
- ETli
- Mg (OEt) 2
- Al 2 O 3
- AlMe 3
- CrCl 6
- VCl 5
- MgO
Como se indicó anteriormente, una vez que un alqueno se une al metal de transición, un alquilo inicial que previamente se transfirió del aluminio es capaz de participar en una reacción de inserción 1,2-. Como resultado, el alqueno se incorpora a la cadena alquílica. Las etapas posteriores de asociación de alquenos y 1,2-inserción sirven para extender la cadena, eventualmente en oligómeros y luego polímeros.
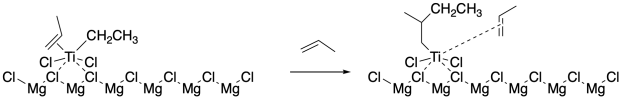
También se han utilizado comercialmente catalizadores homogéneos para estas polimerizaciones. Estos sistemas han sido desarrollados más recientemente por Walter Kaminsky de la Universidad de Hamburgo, Alemania y Hans-Herbert Brintzinger en la Universidad de Constanza, Alemania. Estos catalizadores solubles han ampliado el alcance del control estereoquímico sobre la polimerización de propeno y otros alquenos terminales o 1-olefinas.
Cuando el propeno se engancha en un polímero, se forma un nuevo centro quiral en cada posición donde un grupo metilo se ramifica de la cadena principal. En lugar de tratar de asignar a cada uno de estos centros quirales configuraciones estereoquímicas (R) o (S), describimos las relaciones estereoquímicas relativas a lo largo de la columna vertebral. El término utilizado para describir estas relaciones es “tacticidad”. Si no existe una relación aparente entre la proyección de los grupos metilo a lo largo de la cadena principal, el polímero se denomina “atáctico”. Si los grupos metilo se alternan, apuntando primero una dirección, luego la otra, a lo largo de la cadena, entonces el polímero se denomina “sindiotáctico”. Si todos los grupos metilo proyectan la misma dirección, el polímero se describe como “isotáctico”.
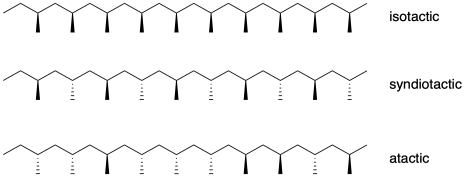
La tacticidad en los polímeros se determina frecuentemente mediante espectroscopía de RMN. Debido a que los diastereómeros tienen diferentes propiedades físicas, muestran cambios ligeramente diferentes en el espectro de RMN 1H o 13C. En una cadena polimérica, pensamos en los centros quirales en pares, a los que llamamos “diadas”, porque cada par de centros quirales tiene dos posibles relaciones diastereoquímicas y por lo tanto dos posibles desplazamientos químicos. Si los grupos metilo están del mismo lado, los centros quirales tienen una relación “meso”, mientras que si están en lados opuestos, tienen una relación “racemo”.
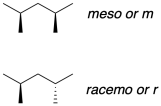
En principio, se trata de dos relaciones estereoquímicas diferentes que podrían dar lugar a dos señales de RMN diferentes. Si el polímero es verdaderamente isotáctico, podríamos ver solamente la señal que viene de la meso diada, porque todos los estereocentros tendrían esa misma relación a lo largo de la cadena. Si el polímero es verdaderamente sindiotáctico, podríamos ver solo la señal de la díada racemo, a un cambio químico ligeramente diferente al meso. Por otro lado, podríamos ver dos señales, y la integración relativa de las dos señales podría indicar que el polímero es mayormente sindiotáctico, en su mayoría isotáctico, o completamente atáctico.
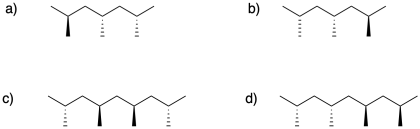
Ejercicio 2.1.2
Etiquete las siguientes diadas.
![]()
Podemos expandirnos a partir de ahí para pensar en tríadas, una secuencia de tres centros quirales, considerando la relación entre el primer par de centros quirales en la tríada y luego el siguiente par. Entonces describiríamos estas relaciones como mm, para dos relaciones meso seguidas; rr, para dos relaciones racémicas seguidas; o mr, para una relación meso y una relación racemo. Podríamos ser capaces de detectar diferentes señales para todas estas relaciones.
Dada una intensidad de campo magnético lo suficientemente grande como un espectrómetro de RMN, incluso podemos detectar la diferencia entre diadas y tétradas, lo que nos permite ver más detalles a lo largo de diferentes segmentos de la cadena principal del polímero.
Ejercicio 2.1.1
Etiquetar las siguientes tríadas y tétradas.
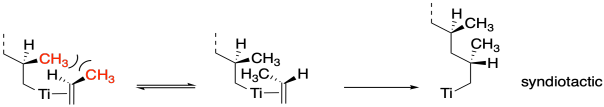
El control sobre la estereoquímica del polímero ocurre típicamente de una de dos maneras. La primera forma se llama control final de cadena. Dado un estereocentro existente al final de la cadena, el enfoque del siguiente monómero se verá influenciado por cómo ese centro quiral existente se proyecta en el espacio. Como resultado, el último centro quiral influye en cómo se forma el siguiente. Conceptualmente, esta idea es lo mismo que decir que en una simple reacción orgánica, un centro quiral existente puede forzar a un grupo entrante a una cara de una molécula en lugar de otra, conduciendo a la formación preferencial de una estereoquímica particular donde se hace el nuevo enlace. En el caso de los polímeros, significa la primera reacción de inserción, cuando se forma el primer centro quiral, determina todas las estereoquímicas posteriores a lo largo de la cadena. Por supuesto, no hay una manera sencilla de predecir cuál será esa estereoquímica: sindiotáctica o isotáctica. Sin embargo, el siguiente dibujo muestra cómo tal interacción podría conducir a un polímero sindiotáctico.
El segundo mecanismo se llama control de sitio. En el control de sitio, la forma específica del reactivo o catalizador que facilita la reacción también determina la estereoquímica. Esta idea también se ve en las reacciones orgánicas. Los reactivos o catalizadores quirales, ya sea para hidrogenaciones, hidroboraciones u otras reacciones, encajarán con el sustrato de una manera más fácil que otra, conduciendo a la formación preferencial de una estereoquímica y no de la otra.
El control del sitio es un tema de interés en la catálisis homegena, así que veamos cómo funcionaría en un titanoceno. La primera lección básica en química del titanoceno es que los dos ciclopentadienilos forman un ángulo entre sí, de manera que la molécula adquiere un poco de forma de cuña. Un extremo de los titanocenos se cierran más juntos, y el otro extremo es más abierto. Es como una concha de almeja.
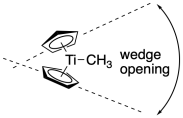
Si otra molécula, como un propeno, se acerca a unirse al titanio, tendrá que negociar la forma de cuña para minimizar las interacciones estéricas. Por ejemplo, mantener el grupo metilo alejado del titanio, hacia la abertura de la cuña, causaría menos apiñamiento que si el metilo girara para proyectarse más profundamente dentro de la cuña.
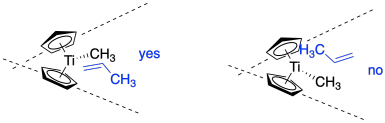
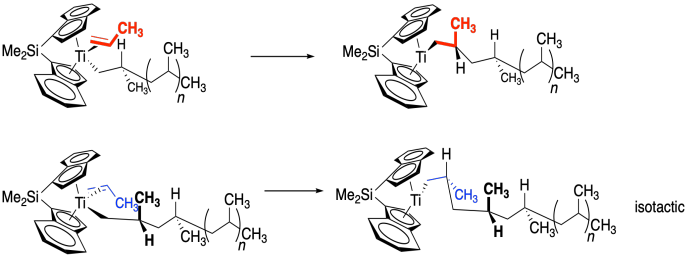
Al discutir la formación de un nuevo centro quiral, la idea clave es si un nuevo grupo se unirá a una cara de una molécula o a la otra cara. Vamos a mostrar una cara del propeno en azul y la otra en rojo para enfatizar esta diferencia. Hasta el momento, el metilo del propeno permanecerá más alejado del titanio, pero no hay nada que impida que el propeno se voltee; el grupo metilo podría estar arriba o abajo en la imagen.
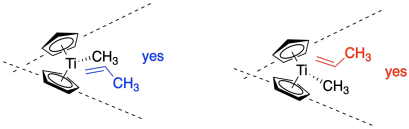
Gran parte del enfoque en estos catalizadores homogéneos ha estado en desarrollar algún tipo de asimetría en el catalizador. El catalizador que se muestra a continuación tiene simetría de C. La parte superior ahora es diferente de la inferior. Específicamente, el fondo está mucho más cantado, por lo que ya no es muy probable que el propeno se acerque con su grupo metilo abajo. Sería mucho más fácil entrar con su grupo metilo apuntado en esta imagen.

Para agregar una arruga más, el propeno no se va a unir en medio de la cuña, sino que estará apagado a un lado o al otro. Eso es porque ya debería haber un grupo alquilo en el metal, que hemos mostrado en este caso como un simple grupo metilo. El propeno podría acercarse desde el lado cercano, frente al metilo (mostrado a la izquierda), o desde el lado lejano, detrás del metilo (mostrado a la derecha).

Si el propeno está en el lado cercano desde nuestra perspectiva, en realidad está presentando su cara azul a la cadena alquílica. Cuando ocurre la inserción 1,2-, el alquilo se unirá a la cara azul, empujando el metilo y el hidrógeno del propeno hacia nosotros (visto en la imagen superior). Sin embargo, si el propeno está en el otro lado desde nuestra perspectiva, realmente está presentando su cara roja a la cadena alquílica. Cuando ocurre la inserción 1,2-, el alquilo se unirá a la cara roja, empujando el metilo y el hidrógeno del propeno lejos de nosotros.
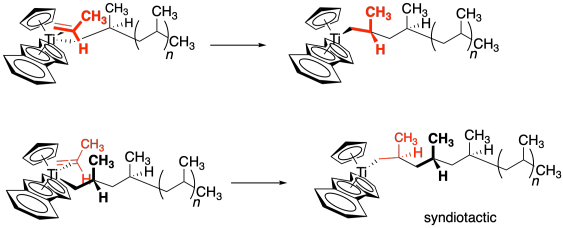
¿Cuál sucede realmente? Ambos. Durante la inserción, la cadena alquílica se desplaza a la olefina coordinada, abriendo un sitio de coordinación. Observe en la imagen superior de arriba, el propeno está en una cuña y el alquilo está en un guión. Después de la inserción, la cadena alquílica está en una cuña y un nuevo sitio de coordinación se abre detrás de ella. Un nuevo propeno se traslada a ese sitio. En consecuencia, el nuevo propeno se acerca primero de un lado, luego del otro, alternativa cada vez. Este mecanismo de lavaparabrisas da como resultado una estereoquímica sindiotactiva.
¿Qué es lo que cambiamos la forma del catalizador? En la imagen de abajo, tenemos un catalizador con simetría C 2. Con esta simetría, el propeno puede acercarse con su metilo arriba solo si viene del frente. Con su metilo abajo, sólo puede acercarse por la parte trasera.
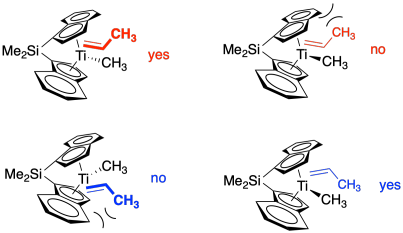
Si lo piensas, eso significa que el propeno siempre está presentando la misma cara al metal. Sólo se une al titanio a través de la cara azul. Eso significa que la cadena alquílica siempre se une a la cara azul. Si el alquilo siempre se une a la misma cara, siempre está formando un nuevo centro quiral con la misma configuración. Es hacer un polímero isotáctico.