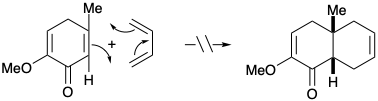4.9: Preguntas de estudio
- Page ID
- 70301
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
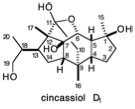
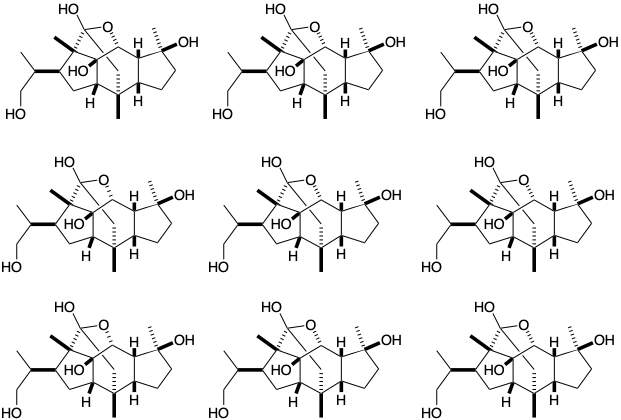
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)1. Circula los “átomos comunes” en cincassiol D 1, un diterpeno, y luego dibuja líneas onduladas a través de cada enlace C-C que involucra al menos un átomo común y que se encuentra en un circuito consonante (consulte su respuesta a la pregunta 4 en el capítulo 1 para un análisis de reactividad polar del cincassiol D 1). Es posible que desee utilizar las estructuras a continuación como plantillas para algunos de sus dibujos. Simplemente “blanqueza” los enlaces no deseados.
(a) Para cada una de las dislocaciones sugeridas por su análisis topológico y haciendo referencia a su análisis polar anterior, dibuje un sintón que teóricamente podría proporcionar el esqueleto diana mediante reacciones formadoras de enlaces C-C polares.
(b) Para algunos de estos sintones dibujar un precursor funcionalizado (equivalente sintético) que podría ser utilizado en una síntesis polar directa de la diana o que podría ser utilizado en una síntesis polar que requiera la adición de un grupo metilo y/o la formación de un enlace C-O heterocíclico después de la finalización del Esqueleto multicíclico de carbono por formación de enlaces C-C polares.
(c) Para los sintones restantes que contienen circuitos consonantes bloqueados por centros cuaternarios, los equivalentes sintéticos que explotan la activación polar que proporcionan los grupos funcionales relacionados con la diana no están disponibles ya que la conjugación de estos grupos funcionales con uno o ambos de los centros de carbono reaccionantes no se logra fácilmente sin la escisión previa de enlaces carbono-carbono adicionales. Marcar estos sintones como “BLOQUEADOS”.
2. La deducción de biosíntesis probables de terpenos brinda una excelente oportunidad para practicar el análisis retrosintético con un conjunto de condiciones límite: (a) pirofosfato de isopentenilo como material de partida, (b) oligómero acíclico cabeza a cola como intermedio, (c) electrófilo carbocatiónico y enlace C=C π-enlace nucleófilo para la formación de enlaces C-C, (d) todas las reacciones de los intermedios de carbocationes como pasos potenciales, por ejemplo, pérdida de protones β-y reordenamientos por cambios 1,2-C o cambios de hidruro.
a) Deducir biosíntesis probables para los siguientes sesquiterpenos regulares:
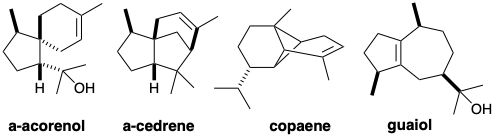
Pista: observe y piense en cualquier similitud en las estructuras de α-acorenol y α-cedreno.
b) El cincassiol D 1 es un diterpeno regular. En la siguiente estructura: (a) circule las unidades de isopreno, (b) trazar líneas onduladas a través de todos los enlaces C-C que no sean enlaces dentro de las unidades de isopreno, (c) para aquellos enlaces nonisopreno que estarían presentes en el pirofosfato de geranilgeranilo acíclico precursor del cincassiol D 1, etiquetar los extremos con h o t para indicar un átomo de cabeza o cola de una unidad de isopreno.
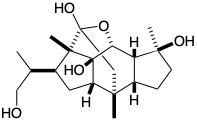
(c) Dibujar un círculo alrededor de cada uno de los “átomos comunes” (según lo define Corey) en la siguiente estructura del lanosterol (1).
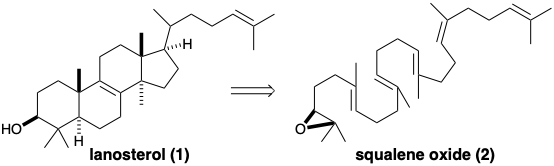
d) Describir la estrategia topológica de la biosíntesis de lanosterol (1) a partir de óxido de escualeno (2).
(e) Escribir un mecanismo para la ciclación y reordenamiento de polienos involucrados en la biosíntesis de lanosterol (1) a partir de óxido de escualeno (2). Mostrar el flujo de electrones con flechas apuntando desde pares de electrones en los reactivos hasta su ubicación inminente en los productos incipientes. Mostrar la ciclación del polieno como un solo proceso concertado que involucra varios pares de electrones y conduce a un catión intermedio. Luego mostrar el reordenamiento de ese intermedio a lanosterol como otro proceso concertado que implica el movimiento de varios pares de electrones.
3. Al dibujar las formas de resonancia apropiadas de un intermedio catiónico clave y uno aniónico clave, escribir un mecanismo que muestre cómo la reacción de formación de enlaces C-C entre 3 y 4 genera 5 mediante un proceso que se basa en la influencia estabilizadora de la funcionalidad en 3 y 4 que se relaciona con los grupos 3-hidroxilo y 17-keto en la diana sintética final, estrona (6).
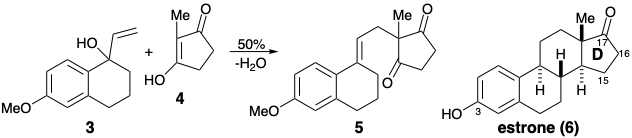
Pista: 4 es un ácido carboxílico vinilógico.
4. Para cada una de las siguientes reacciones que generan un alqueno trisustituido estereoselectivamente, ¿cuál es la fuerza impulsora y por qué es estereoespecífico?
a)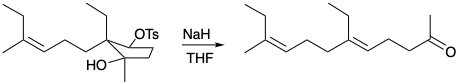
b)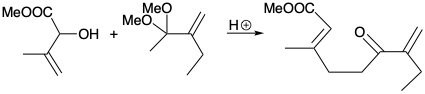
c)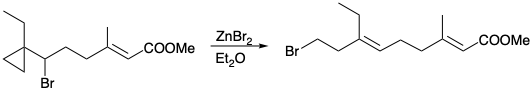
5. Una reacción notable ocurre tras la irradiación UV de 7 y 8. Un producto 9, que contiene el esqueleto de loganina se genera estereoselectivamente.
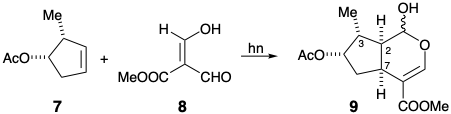
(a) Escribir un mecanismo para esta reacción. Mostrar el flujo de electrones con flechas apuntando desde pares de electrones en los reactivos hasta su ubicación inminente en los productos incipientes.
b) Utilizar uno o más de los siguientes términos para responder a cada una de las siguientes preguntas: control termodinámico, control estereoelectrónico, control de aproximación estérica o puente temporal. ¿Cómo se logra el estereocontrol: (i) en la posición 3 con relación a la posición 2 en 9? ii) en la posición 7 con relación a la posición 2 en 9?
6. En la síntesis de Kojima-Saki de PGF 1α, la estereoquímica relativa en las posiciones 8, 9 y 12 se establece en la conversión de 10 en 11.
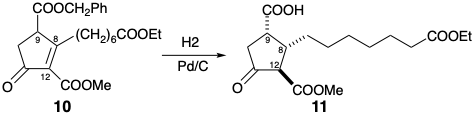
¿Cómo se logra el estereocontrol: i) en la posición 12 con relación a la posición 9 en 11? b) en la posición 8 con relación a la posición 9 en 11?
7. Cada una de las siguientes reacciones falla por un defecto fatal. Para cada reacción dibuje la estructura del producto real.
a)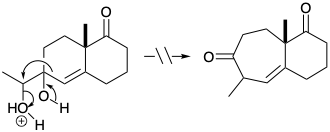
b)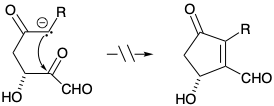
c)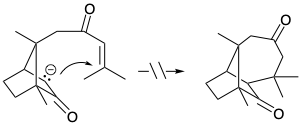
d)